Veuillez saisir au moins 3 caractères pour votre recherche.
- Médicaments
- ELIGARD
- ELIGARD 22,5 mg pdre/solv p sol inj
Mise à jour : 02 septembre 2024
Sommaire
Connectez-vous pour accéder à ce contenu
SYNTHÈSE |
excipient du solvant : polymère DL-lactide coglycolide, N-méthylpyrrolidone
Cip : 3400936690929
Modalités de conservation : Avant ouverture : 2° < t < 8° durant 24 mois (Conserver à l'abri de l'humidité, Conserver au réfrigérateur, Conserver dans son emballage)
FORMES et PRÉSENTATIONS |
Poudre et solvant pour solution injectable.
Poudre (seringue B) : seringue pré-remplie avec une poudre blanche à blanc cassé.
Solvant (seringue A) : seringue pré-remplie avec une solution limpide, incolore à jaune pâle.
Kit contenant 1 plateau thermoformé et 1 aiguille stérile (20 gauge).
Le plateau contient un système de seringues pré-connectées :
Boîte de 1 kit + 1 sachet de dessiccant.
COMPOSITION |
Une seringue pré-remplie de poudre pour solution injectable contient 22,5 mg d'acétate de leuproréline, correspondant à 20,87 mg de leuproréline.
Solvant (seringue A) : poly (D, L-lactide co-glycolide) (25:75), N-méthylpyrrolidone.
Poudre (seringue B) : aucun excipient.
INDICATIONS |
ELIGARD 22,5 mg est indiqué pour le traitement du cancer de la prostate hormono-dépendant à un stade avancé et en association avec la radiothérapie dans le traitement du cancer de la prostate localisé à haut risque et localement avancé hormono-dépendant.
POSOLOGIE ET MODE D'ADMINISTRATION |
Connectez-vous pour accéder à ce contenu
CONTRE-INDICATIONS |
Connectez-vous pour accéder à ce contenu
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
Reconstitution correcte du médicament : Des cas d'erreur de manipulation pouvant se produire à n'importe quelle étape du processus de préparation et pouvant conduire à un manque d'efficacité ont été rapportés. Les instructions de reconstitution et d'administration doivent être strictement respectées (voir la rubrique Elimination/Manipulation). En cas d'erreur de manipulation suspectée ou avérée, le patient doit faire l'objet d'une surveillance adéquate (voir la rubrique Posologie et mode d'administration).
Un traitement par suppression androgénique peut allonger l'intervalle QT : Chez les patients présentant des antécédents ou des facteurs de risques de l'allongement de l'intervalle QT, et chez les patients recevant de manière concomitante des médicaments susceptibles d'allonger l'intervalle QT (voir rubrique Interactions), les médecins doivent évaluer le rapport bénéfice/risque en prenant en compte le risque potentiel de torsades de pointes avant l'initiation du traitement par Eligard 22,5 mg.
Maladies cardiovasculaires : Une augmentation du risque d'infarctus du myocarde, de mort subite par arrêt cardiaque et d'accident vasculaire cérébral ont été rapportés lors de l'utilisation d'agonistes de la GnRH chez certains patients. Le risque semble faible sur la base des rapports publiés et devra être évalué attentivement en fonction des facteurs de risque cardiovasculaires des patients atteints d'un cancer de la prostate lors du choix du traitement. L'apparition de symptômes et des signes évocateurs de maladies cardiovasculaires doit être surveillée chez les patients traités par un agoniste de la GnRH et pris en charge, conformément aux recommandations en vigueur.
Élévation transitoire du taux de testostérone : L'acétate de leuproréline, comme les autres agonistes de la GnRH, entraîne une élévation transitoire des concentrations sériques de testostérone, de dihydrotestostérone et des phosphatases acides pendant la première semaine de traitement. Les patients peuvent présenter une aggravation des symptômes ou voir apparaître de nouveaux symptômes tels que douleurs osseuses, neuropathie, hématurie, obstruction urétérale ou vésicale (voir rubrique Effets indésirables). Ces symptômes disparaissent habituellement à la poursuite du traitement.
L'administration associée d'un anti-androgène approprié doit être envisagée en commençant 3 jours avant le traitement par leuproréline et en poursuivant pendant les deux à trois premières semaines de traitement. Il a été observé que ces modalités permettent de prévenir les conséquences d'une augmentation initiale de testostérone sérique.
Après castration chirurgicale, ELIGARD 22,5 mg n'entraîne pas de diminution supplémentaire de la testostéronémie chez les sujets masculins.
Densité osseuse : Une diminution de la densité osseuse a été rapportée dans la littérature médicale chez les hommes ayant subi une orchidectomie ou ayant été traités par un agoniste de la GnRH (voir rubrique Effets indésirables).
Le traitement anti-androgène augmente de façon significative le risque de fractures secondaires à une ostéoporose. Il n'existe qu'un nombre limité de données à ce sujet. Des fractures secondaires à une ostéoporose ont été observées chez 5 % des patients après 22 mois de traitement pharmacologique de privation androgénique et chez 4 % des patients après 5 à 10 ans de traitement. Le risque de fractures d'origine ostéoporotique est généralement plus élevé que le risque de fractures pathologiques. En dehors d'un déficit prolongé en testostérone, un âge avancé, le tabagisme et la consommation de boissons alcoolisées, l'obésité et le manque d'exercice physique peuvent aussi favoriser le développement d'une ostéoporose.
Apoplexie pituitaire : Lors de la surveillance après la commercialisation, de rares cas d'apoplexie pituitaire (un syndrome clinique secondaire à un infarctus de la glande pituitaire) ont été rapportés après l'administration d'agonistes de la GnRH, la majorité survenant dans les 2 semaines suivant la première administration, et certaines dans la première heure. Dans ces cas, l'apoplexie pituitaire s'est manifestée sous la forme d'une céphalée soudaine, de vomissements, de troubles de la vision, d'ophtalmoplégie, d'un état mental altéré, et parfois d'un collapsus cardiovasculaire. Une prise en charge médicale immédiate est requise.
Hyperglycémie et diabète : Une hyperglycémie et une augmentation du risque de développer un diabète ont été rapportées chez des hommes traités par des agonistes de la GnRH. Une hyperglycémie peut être due au développement d'un diabète sucré ou à l'aggravation du contrôle glycémique chez des patients diabétiques. Chez les patients traités par un agoniste de la GnRH, il faut surveiller périodiquement la glycémie et/ou l'hémoglobine glyquée (HbA1c) et prendre en charge ces patients selon les recommandations actuelles de traitement de l'hyperglycémie ou du diabète.
Convulsions : Des cas de convulsions ont été signalés après la commercialisation chez des patients traités par acétate de leuproréline avec ou sans antécédents de facteurs prédisposants. Ces convulsions doivent être prises en charge selon la pratique clinique actuelle.
Hypertension intracrânienne idiopathique : Des cas d'hypertension intracrânienne idiopathique (méningite séreuse) ont été rapportés chez des patients recevant de la leuproréline. Les patients doivent être avertis de la possibilité de signes et symptômes d'hypertension intracrânienne idiopathique, notamment des céphalées sévères ou récurrentes, de troubles visuels et d'acouphènes. En présence d'une hypertension intracrânienne idiopathique, l'interruption du traitement par leuproréline doit être envisagée.
Autres événements : Des cas d'obstruction urétérale et de compression médullaire susceptibles d'entraîner une paralysie avec ou sans complications fatales, ont été rapportés avec les agonistes de la GnRH. L'apparition d'une compression médullaire ou d'une insuffisance rénale impose l'instauration d'un traitement standard de ces complications.
Les patients ayant des métastases vertébrales et/ou cérébrales ainsi que les patients ayant une obstruction des voies urinaires devront être étroitement surveillés pendant les premières semaines de traitement.
INTERACTIONS |
Connectez-vous pour accéder à ce contenu
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Sans objet du fait qu'ELIGARD 22,5 mg est contre-indiqué chez les femmes.
CONDUITE et UTILISATION DE MACHINES |
Les effets d'ELIGARD 22,5 mg sur l'aptitude à conduire des véhicules et à utiliser des machines n'ont pas été étudiés.
La fatigue, les vertiges et les troubles de la vision étant des effets indésirables possibles du traitement ou la conséquence de la maladie sous-jacente, l'aptitude à conduire des véhicules et à utiliser des machines peut être altérée.
EFFETS INDÉSIRABLES |
Connectez-vous pour accéder à ce contenu
SURDOSAGE |
L'emploi abusif et le surdosage volontaire avec ELIGARD 22,5 mg sont peu probables. Aucun cas d'emploi abusif ou de surdosage n'a été rapporté en pratique clinique avec l'acétate de leuproréline, mais si une exposition excessive se produisait, la surveillance du patient et l'administration d'un traitement symptomatique adjuvant sont recommandées.
PHARMACODYNAMIE |
Connectez-vous pour accéder à ce contenu
PHARMACOCINÉTIQUE |
Connectez-vous pour accéder à ce contenu
SÉCURITÉ PRÉCLINIQUE |
Les études pré-cliniques avec l'acétate de leuproréline ont montré des effets sur le système de reproduction des deux sexes, effets attendus compte-tenu du profil pharmacologique connu. Ces effets se sont révélés réversibles après l'arrêt du traitement et une période appropriée de régénération. L'acétate de leuproréline n'a pas révélé d'activité tératogène. Une embryotoxicité/létalité a été observée chez le lapin, liée aux effets pharmacologiques de l'acétate de leuproréline sur l'appareil reproducteur.
Des études de cancérogénicité ont été réalisées chez le rat et la souris pendant 24 mois. Chez le rat, une augmentation dose-dépendante des apoplexies pituitaires a été observée après administration sous-cutanée aux doses de 0,6 à 4 mg/kg/jour. Aucun effet de ce type n'a été observé chez la souris.
L'acétate de leuproréline et la formulation 1 mois ELIGARD 7,5 mg ne se sont pas révélés mutagènes lors de tests réalisés in vitro et in vivo.
INCOMPATIBILITÉS |
La leuproréline contenue dans la seringue B doit être mélangée uniquement avec le solvant de la seringue A et ne doit pas être mélangée à d'autres médicaments.
DURÉE DE CONSERVATION |
Avant reconstitution :
2 ans.
Une fois que le produit a été sorti du réfrigérateur, il peut être conservé dans l'emballage d'origine à température ambiante (ne dépassant pas 25 °C) pendant 4 semaines maximum.
Après la première ouverture du plateau, la poudre et le solvant pour solution injectable doivent être immédiatement utilisés pour reconstituer le médicament et l'administrer au patient.
Une fois reconstitué : administrer le produit immédiatement, la viscosité de la solution augmentant avec le temps.
PRÉCAUTIONS PARTICULIÈRES DE CONSERVATION |
A conserver au réfrigérateur (entre 2 °C et 8 °C).
A conserver dans l'emballage extérieur d'origine, à l'abri de l'humidité.
Ce produit doit être à température ambiante avant l'injection. Le sortir du réfrigérateur environ 30 minutes avant utilisation. Une fois sorti du réfrigérateur, le produit peut être conservé dans son emballage d'origine à température ambiante (ne dépassant pas 25 °C) pendant 4 semaines maximum.
PRÉCAUTIONS PARTICULIÈRES D'ÉLIMINATION ET DE MANIPULATION |
Laisser le produit se réchauffer à température ambiante en le sortant du réfrigérateur environ 30 minutes avant utilisation.
Merci de préparer en premier le patient pour l'injection, puis la préparation du produit, en suivant les instructions ci-dessous. En cas de préparation inadéquate du produit, ce dernier ne doit pas être administré, puisqu'un manque d'efficacité clinique peut survenir du fait d'une reconstitution incorrecte du produit.
Etape 1 :
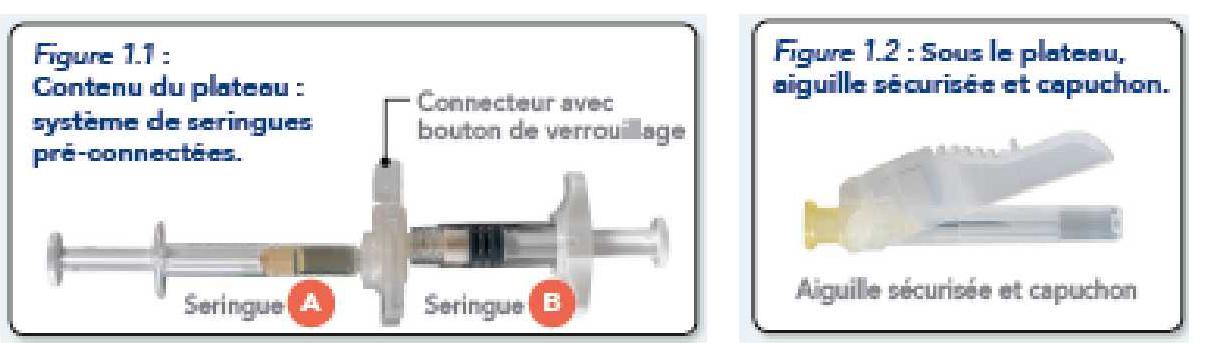
Sur un plan de travail propre, ouvrir le plateau en retirant la feuille d'aluminium par le coin pour retirer le contenu. Jeter le sachet de dessiccant.
Retirer le système de seringues pré-connectées (Figure 1.1) du plateau. Ouvrir l'emballage de l'aiguille sécurisée (Figure 1.2) en décollant la languette de papier.
Remarque : La seringue A et la seringue B ne doivent pas encore être alignées.
Etape 2 :
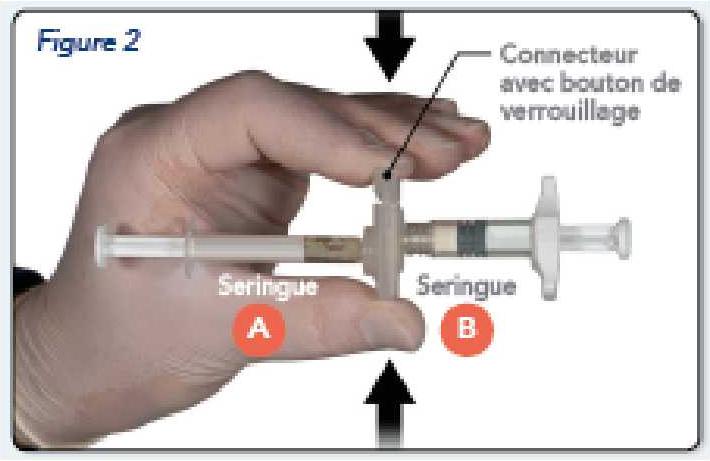
Prendre le bouton de verrouillage du connecteur avec le doigt et le pouce et appuyer (Figure 2) jusqu'à entendre un claquement. Les deux seringues seront alors alignées. Aucune orientation particulière du système de seringues n'est nécessaire pour activer le connecteur. Ne pas plier le système de seringues (cela peut provoquer des fuites car vous risquez de dévisser partiellement les seringues).
Etape 3 :
En tenant les seringues en position horizontale, transférer le contenu liquide de la seringue A dans la seringue B qui contient la poudre d'acétate de leuproréline.
Mélanger soigneusement le produit pendant 60 cycles en poussant doucement le contenu des deux seringues d'avant en arrière entre les deux seringues (un cycle correspond à une poussée du piston pour la seringue A et une poussée du piston pour la seringue B) en position horizontale, pour obtenir une solution homogène et visqueuse (Figure 3). Ne pas plier le système de seringues (cela peut provoquer des fuites car vous risquez de dévisser partiellement les seringues).
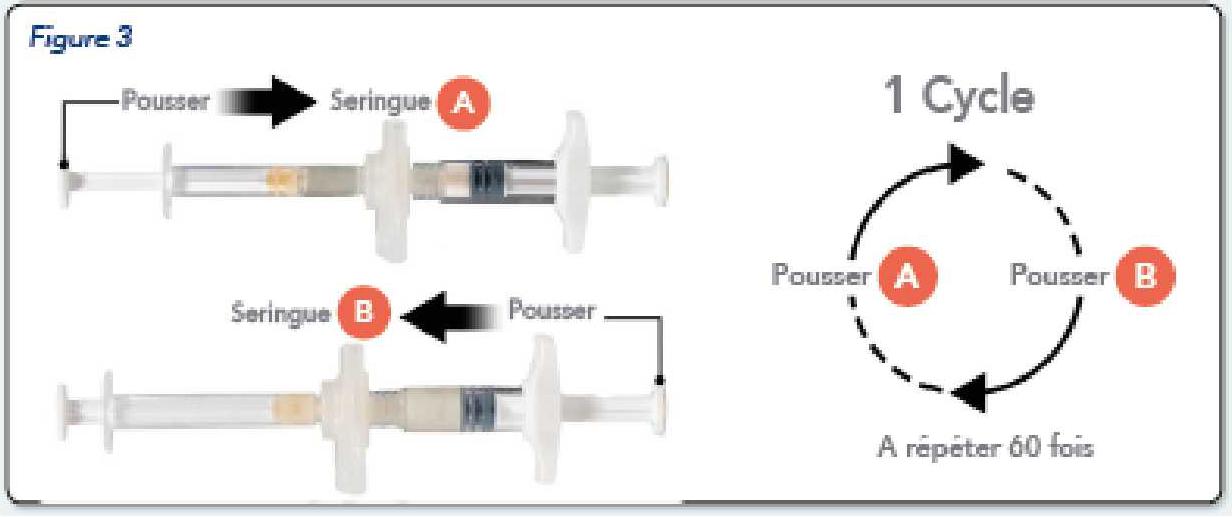
Parfaitement mélangé, le produit apparaitra visqueux avec une gamme de couleur allant de l'incolore, à blanc, à jaune pâle (ce qui inclut toutes les nuances du blanc au jaune pâle).
Important : Après avoir procédé au mélange, passer à l'étape suivante immédiatement, le produit devenant de plus en plus visqueux avec le temps. Ne pas mettre au réfrigérateur le produit mélangé.
Merci de noter que le produit doit être mélangé comme décrit ; LE SECOUER NE MELANGERA PAS LE PRODUIT CORRECTEMENT.
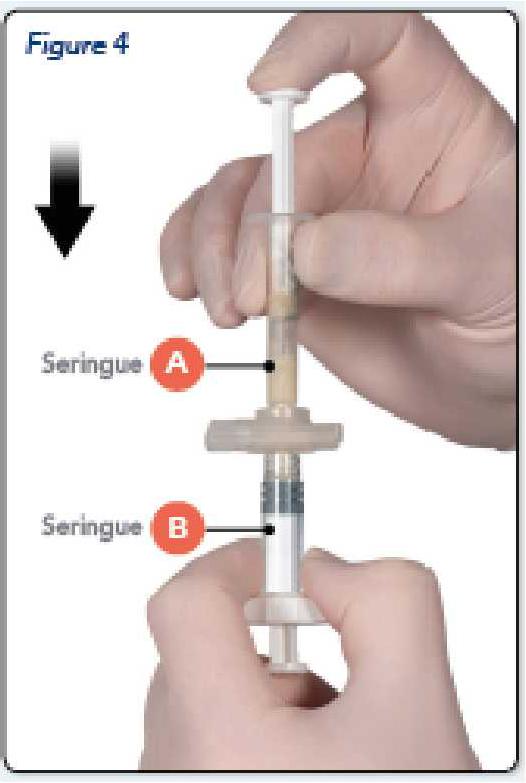
Etape 4 :
Après le mélange, tenir les seringues en position verticale, la seringue B étant en bas. Les seringues doivent rester bien assemblées. Transférer tout le produit mélangé dans la seringue B (la seringue large) en poussant le piston de la seringue A et en tirant doucement le piston de la seringue B en même temps (Figure 4).
Etape 5 :
Tout en s'assurant que le piston de la seringue A est complètement enfoncé, tenir le connecteur et le dévisser de la seringue B. La seringue A restera attachée au connecteur (Figure 5).
S'assurer que le produit ne fuit pas car sinon l'aiguille ne sera pas correctement fixée.
Merci de noter : Il pourra rester des petites bulles d'air ou une grosse bulle d'air dans la préparation. Ceci n'est pas gênant.
Au cours de cette étape, merci de ne pas essayer de purger les bulles d'air de la seringue B car du produit pourrait être perdu !

Etape 6 :
Ne pas trop serrer car ceci peut fissurer l'embase de l'aiguille, entraînant une fuite du produit durant l'injection. Le dispositif de sécurité peut être également endommagé si l'aiguille est vissée avec trop de force.
Si l'embase de l'aiguille se fissure, semble endommagée ou présente la moindre fuite, le produit ne doit pas être utilisé. L'aiguille endommagée ne doit pas être substituée/remplacée et le produit ne doit pas être injecté. La totalité du produit doit être éliminée de manière sécurisée.
Si l'embase de l'aiguille est endommagée, un nouveau produit doit être utilisé en remplacement.

Etape 7 :
Ecarter le dispositif de sécurité de l'aiguille et retirer le capuchon protecteur de l'aiguille uniquement avant l'administration du produit (Figure 7).
Important : N'enclenchez pas le dispositif de sécurité de l'aiguille avant l'administration.
Si l'embout de l'aiguille semble endommagé ou présente une fuite, le produit ne doit PAS être utilisé. L'aiguille endommagée ne doit PAS être remplacée et le produit ne doit PAS être injecté. Dans ce cas, utilisez une autre boîte d'ELIGARD.

Etape 8 :
Avant administration, purger les grosses bulles d'air de la seringue B. Administrer le produit par voie sous cutanée tout en maintenant le dispositif de sécurité écarté de l'aiguille.
| Procédure d'administration :
|
|
Etape 9 :
Après injection, verrouiller le dispositif de sécurité en suivant les instructions listées ci-dessous :
1. Fermeture sur une surface plane
Appuyer sur le dispositif de sécurité, levier en bas, sur une surface plane (Figure 9a) pour recouvrir l'aiguille et verrouiller le dispositif de sécurité.
Un « Clic » confirme, de façon sonore et tactile, que le dispositif est verrouillé. En position verrouillée, la pointe de l'aiguille est complètement recouverte.
2. Fermeture avec votre pouce
Placer votre pouce sur le dispositif de sécurité (Figure 9b), recouvrir la pointe de l'aiguille et verrouiller le dispositif de sécurité.

Un « Clic » confirme, de façon sonore et tactile, que le dispositif est verrouillé. En position verrouillée, la pointe de l'aiguille est complètement recouverte.
Une fois que le dispositif de sécurité est verrouillé, jeter l'aiguille et la seringue immédiatement dans une poubelle appropriée.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| AMM |
|
| Prix : |
|