Classification pharmacothérapeutique VIDAL
Hémostase - Hématopoïèse - Hémoglobinopathies > Antihémorragiques (Facteurs sanguins de la coagulation)
Classification ATC
SANG ET ORGANES HEMATOPOIETIQUES > ANTIHEMORRAGIQUES > VITAMINE K ET AUTRES HEMOSTATIQUES > FACTEURS DE LA COAGULATION SANGUINE (COMPLEXE PROTHROMBIQUE ACTIVE)
Excipients
sodium chlorure,
sodium citrate excipient du solvant : eau ppi
Excipients à effet notoire :
EEN avec dose seuil : sodium
Présentations
FEIBA 50 U/ml Pdre/solv p sol inj Fl+solv/10ml+aig
Cip : 3400955055174
Modalités de conservation : Avant ouverture : < 25° durant 24 mois (Ne pas congeler)
FEIBA 50 U/ml Pdre/solv p sol inj Fl+solv/20ml
Cip : 3400956451500
Modalités de conservation : Avant ouverture : < 25° durant 24 mois (Ne pas congeler)
FEIBA 50 U/ml Pdre/solv p sol inj Fl+Solv/50ml+aig
Cip : 3400955055181
Modalités de conservation : Avant ouverture : < 25° durant 24 mois (Ne pas congeler)
| | p ml |
Facteurs de coagulation ayant une activité court-circuitant l'inhibiteur du facteur VIII
| 50 U* |
Excipients (poudre) : chlorure de sodium, citrate de sodium.
Solvant de reconstitution : eau pour préparations injectables.
Excipient à effet notoire : sodium (chlorure et citrate) (approximativement 40 mg/fl de 10 ml (500 U) ; 80 mg/fl de 20 ml (1000 U) ; 200 mg/fl de 50 ml (2500 U)).
Un flacon de 10 ml contient 500 U de facteurs de coagulation ayant une activité court-circuitant l'inhibiteur du facteur VIII dans 200 à 600 mg de protéines totales**.
Un flacon de 20 ml contient 1000 U de facteurs de coagulation ayant une activité court-circuitant l'inhibiteur du facteur VIII dans 400 à 1200 mg de protéines totales**.
Un flacon de 50 ml contient 2500 U de facteurs de coagulation ayant une activité court-circuitant l'inhibiteur du facteur VIII dans 1000 à 3000 mg de protéines totales**.
* Une unité Feiba est définie comme la quantité de substance active qui permet de raccourcir le temps de céphaline activé (TCA) d'un plasma de référence à haut titre d'inhibiteur de facteur VIII, de 50 % par rapport à la valeur du contrôle (c'est-à-dire que si le TCA du plasma inhibiteur est de 100 secondes, l'unité est la quantité de produit actif qui amène le TCA à 50 secondes) lorsque des volumes équivalents d'une solution de Feiba et du plasma inhibiteur sont utilisés.
**
Comprenant notamment les facteurs de coagulation II, IX et X, principalement sous forme non activée, du facteur VII principalement sous forme activée, du facteur VIII (FVIIIC : Ag) à une concentration inférieure à 0,1 U par unité Feiba.
Les facteurs du système kallicréine-kinine ne sont pas décelables ou n'existent qu'à l'état de traces.
Ce médicament est indiqué :
- Dans le traitement des hémorragies et en situation chirurgicale, dans le déficit constitutionnel en facteur VIII (hémophilie A), chez les patients « forts répondeurs » ayant développé un inhibiteur dirigé contre le facteur VIII.
- En cas d'échec par le facteur VIIa, dans le traitement des hémorragies et, en situation chirurgicale, dans le déficit constitutionnel en facteur IX (hémophilie B), chez les patients « forts répondeurs » ayant développé un inhibiteur dirigé contre le facteur IX.
- En fonction de l'évaluation médicale, en prophylaxie pour prévenir ou réduire la fréquence des hémorragies chez les patients présentant des épisodes hémorragiques très fréquents et hémophiles A « forts répondeurs » ayant développé un inhibiteur dirigé contre le facteur VIII ou hémophiles B « forts répondeurs » ayant développé un inhibiteur dirigé contre le facteur IX, après échec par le facteur VIIa.
- Dans le traitement des hémorragies et, en situation chirurgicale, chez les patients avec hémophilie acquise par auto-anticorps anti-facteur VIII.
POSOLOGIE ET MODE D'ADMINISTRATION |
Connectez-vous pour accéder à ce contenu
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
Traçabilité :
Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
Mises en garde :
-
Événements thromboemboliques :
- Les événements thromboemboliques de type coagulation intravasculaire disséminée (CIVD), thrombose veineuse, embolie pulmonaire, infarctus du myocarde et accident vasculaire cérébral peuvent survenir au cours du traitement par Feiba.
- Certains de ces événements sont survenus avec des doses supérieures à 200 U/kg/jour ou chez des patients présentant des facteurs de risque thrombotique (notamment une coagulation intravasculaire disséminée [CIVD], une athérosclérose à un stade avancé, une blessure par écrasement ou une septicémie). Une augmentation du risque de survenue d'événement thromboembolique est possible chez les patients traités par un facteur VIIa en association. La présence éventuelle de tels facteurs de risque doit toujours être recherchée chez les patients atteints d'hémophilie congénitale ou acquise.
- Feiba doit été utilisé avec précaution chez les patients présentant un risque de CIVD, de thrombose artérielle ou veineuse (cf Contre-indications).
- Dès les premiers signes ou symptômes d'événements thromboemboliques, l'injection doit immédiatement être arrêtée et un diagnostic et des mesures thérapeutiques appropriés doivent être instaurés.
- Ne pas dépasser la dose de 100 U de Feiba par kg de poids corporel et par injection et 200 U par kg de poids corporel par jour à moins que la gravité du saignement ne justifie l'utilisation de doses plus importantes.
- Lorsqu'il est utilisé pour arrêter le saignement, le produit doit uniquement être administré aussi longtemps que nécessaire pour atteindre l'objectif thérapeutique.
- Aucun cas de microangiopathie thrombotique (MAT) n'a été rapporté dans les études cliniques investiguant Feiba. Des cas de MAT ont néanmoins été rapportés dans un essai clinique avec l'emicizumab dans lequel les sujets ont reçu une administration concomitante de Feiba pour le traitement de saignements intercurrents. La sécurité et l'efficacité de Feiba n'ont pas été établies pour les saignements intercurrents des patients traités par l'emicizumab. Les bénéfices et les risques doivent donc être systématiquement évalués si Feiba doit être utilisé chez un patient recevant de l'emicizumab en prophylaxie.
- Si un traitement avec Feiba est considéré comme nécessaire pour des patients recevant également de l'emicizumab, ceux-ci devront être étroitement suivis par leur équipe médicale (voir le résumé des caractéristiques de l'emicizumab).
-
Réactions allergiques du type hypersensibilité :
- Comme pour tout médicament dérivé du plasma administré en IV, des réactions d'hypersensibilité de type allergiques peuvent survenir. Les patients doivent être informés des premiers signes de réactions d'hypersensibilité incluant des démangeaisons, une urticaire généralisée, un angio-œdème, des manifestations gastro-intestinales, des bronchospasmes, des râles, une chute de tension, un choc anaphylactique et un choc circulatoire. D'autre réactions ont également été rapportées telles que frissons, fièvre et hypertension. Si ces symptômes surviennent, les patients doivent arrêter le traitement et contacter leur médecin immédiatement. En cas de choc, le traitement symptomatique de l'état de choc devra être instauré.
- Quand une réexposition au traitement par Feiba est envisagée chez des patients ayant des antécédents suspectés ou connus d'hypersensibilité au produit ou à l'un de ses composants, le rapport bénéfice/risque doit être attentivement évalué et doit prendre en compte les antécédents d'hypersensibilité (de type allergique ou non) connus ou suspectés des patients, ainsi que la possibilité de traitement préventif associé ou de traitement alternatif avec un autre agent court-circuitant l'inhibiteur.
-
Surveillance du traitement :
- Ne pas dépasser la dose de 100 U de Feiba par kg de poids corporel et par injection et 200 U par kg de poids corporel par jour.
- Les patients qui reçoivent une dose supérieure à 100 U/kg de poids corporel doivent être attentivement contrôlés en ce qui concerne le développement d'une CIVD et/ou l'apparition de symptômes d'ischémie coronarienne aiguë. Des doses élevées de Feiba devraient être administrées seulement tant que cela est strictement nécessaire pour arrêter une hémorragie.
- Si des changements cliniques significatifs apparaissent concernant la tension, le pouls, une détresse respiratoire, une toux ou une douleur à la poitrine, la perfusion doit être arrêtée immédiatement et des mesures diagnostiques et thérapeutiques doivent être initiées. Les marqueurs biologiques indicatifs d'une CIVD sont : la diminution du taux de fibrinogène, la diminution du nombre de plaquettes et/ou la présence de produits de dégradation de la fibrine/du fibrinogène (PDF).
- L'efficacité de Feiba se traduit in vitro par un temps de Quick raccourci, toutefois, pour un temps de Quick basal normal, celui obtenu après injection de Feiba ne doit pas être inférieur à 8 secondes.
- Une thrombopénie peut être responsable d'une inefficacité du traitement par Feiba. Un contrôle de la numération des plaquettes est souhaité avant et en cours de traitement.
- Étant donné le risque de relance anamnestique de l'inhibiteur anti-facteur VIII (dans 10 à 30 % des cas) ou anti-facteur IX, le titre de l'inhibiteur doit être régulièrement surveillé.
- Dans chacune de ces situations, le bénéfice du traitement par Feiba doit être évalué par rapport au risque de complications.
-
Mesures de prévention du risque de transmission d'agents infectieux :
- Les mesures habituelles de prévention du risque de transmission d'agents infectieux par les médicaments dérivés du sang comprennent la sélection clinique des donneurs, la recherche des marqueurs spécifiques d'infection sur chaque don et sur les mélanges de plasma ainsi que la mise en œuvre dans le procédé de fabrication d'étapes efficaces pour l'inactivation/élimination virale. Cependant, lorsque des médicaments dérivés du sang sont administrés, le risque de transmission d'agents infectieux ne peut pas être totalement exclu. Ceci s'applique également aux virus inconnus ou émergents, ou autres types d'agents infectieux.
- Les mesures prises sont considérées comme efficaces vis-à-vis des virus enveloppés tels que le VIH, le VHB et le VHC, et vis-à-vis du virus non enveloppé VHA.
- Les mesures prises peuvent être d'efficacité limitée vis-à-vis des virus non enveloppés tels que le parvovirus B19. L'infection par le parvovirus B19 peut être grave pour les femmes enceintes (infection fœtale) et les personnes immunodéficientes ou atteintes d'une augmentation de l'érythropoïèse (par exemple, une anémie hémolytique).
- Une vaccination appropriée (hépatites A et B) des patients recevant des facteurs de coagulation dont Feiba est recommandée.
Précautions d'emploi :
-
Complications thromboemboliques :
- Dans les situations suivantes, Feiba sera administré uniquement si aucune réponse au traitement par des concentrés de facteurs de coagulation appropriés ne peut être attendue, par exemple en cas d'un fort titre en inhibiteurs et d'une hémorragie mettant en jeu le pronostic vital ou d'un risque de saignement (post-traumatique ou postopératoire) :
- Coagulation intravasculaire disséminée (CIVD).
- Insuffisance hépatique : en présence de tests biologiques et/ou symptômes cliniques en faveur de lésions hépatiques, la diminution de la dégradation des facteurs activés de la coagulation favorise le risque élevé de développer une CIVD.
- Maladie cardiaque coronarienne, thrombose aiguë et/ou embolie.
- La réponse au traitement varie d'un individu à l'autre. Ainsi, en cas d'hémorragies, un patient présentant une réponse insuffisante à un agent court-circuitant l'inhibiteur peut répondre à un autre agent. Dans le cas d'une réponse insuffisante au traitement par un agent court-circuitant l'inhibiteur, l'administration d'un autre agent doit être envisagée.
- L'administration de Feiba chez les patients avec inhibiteurs peut entraîner initialement une augmentation anamnestique du titre de l'inhibiteur, qui peut diminuer dans le temps avec la poursuite du traitement par Feiba. Les données cliniques et les données issues de la littérature suggèrent que l'efficacité de Feiba n'est pas réduite.
-
Interférence avec les tests de laboratoire :
- Après l'administration de doses élevées de Feiba, l'augmentation transitoire d'anticorps de surface anti-hépatite B transférés passivement peut aboutir à une mauvaise interprétation de résultats sérologiques positifs.
- Feiba contient des iso-hémagglutinines (anti-A et anti-B). Une transmission passive d'anticorps aux antigènes érythrocytaires, par exemple A, B, D, peut interférer avec des tests sérologiques pour les anticorps érythrocytaires, tels que le test à l'antiglobuline (ou test de Coombs).
-
Population pédiatrique :
- Des cas rapportés et des données d'études cliniques limitées suggèrent que Feiba peut être utilisé chez des enfants de moins de 6 ans.
-
Sodium :
- 500 U : Feiba contient environ 40 mg de sodium par flacon, ce qui équivaut à 2 % de l'apport quotidien maximal recommandé par l'OMS de 2 g de sodium par adulte.
- 1000 U : Feiba contient environ 80 mg de sodium par flacon, ce qui équivaut à 4 % de l'apport quotidien maximal recommandé par l'OMS de 2 g de sodium par adulte.
- 2500 U : Feiba contient environ 200 mg de sodium par flacon, ce qui équivaut à 10 % de l'apport quotidien maximal recommandé par l'OMS de 2 g de sodium par adulte.
FERTILITÉ/GROSSESSE/ALLAITEMENT |
La tolérance de Feiba pendant la grossesse et l'allaitement n'a pas été établie.
Les médecins doivent évaluer attentivement les risques et les bénéfices pour chaque patiente avant de prescrire Feiba.
Il existe un risque thrombotique élevé durant la grossesse et la période du post partum, et plusieurs complications de la grossesse sont associées à un risque élevé de CIVD.
Aucune étude expérimentale sur la reproduction n'a été conduite chez l'animal.
Les effets de Feiba sur la fertilité n'ont pas été établis lors d'essais cliniques contrôlés.
Cf Mises en garde et Précautions d'emploi pour des informations sur l'infection par le parvovirus B19.
CONDUITE et UTILISATION DE MACHINES |
Rien ne suggère que Feiba diminue l'aptitude à conduire des véhicules ou à utiliser des machines.
Certains des événements thromboemboliques ont été rapportés avec des doses supérieures à 200 U/kg de poids corporel.
Si des signes en faveur de tels accidents apparaissent, il est nécessaire d'arrêter l'administration de Feiba et de prendre les mesures thérapeutiques spécifiques, en tenant compte du trouble de la coagulation sous-jacent (cf Mises en garde et Précautions d'emploi).
Aucune étude sur la toxicité par administration réitérée n'a été réalisée (en raison du développement des anticorps chez les animaux).
Aucune potentialité mutagène n'a été révélée sur cellules procaryotes (test d'Ames).
Aucune étude de compatibilité n'a été menée avec Feiba. Par conséquent, Feiba ne doit en aucun cas être mélangé avec d'autre produit et/ou médicament.
Seuls les dispositifs d'injection/perfusion en plastique homologués peuvent être utilisés, car l'adsorption des facteurs de coagulation dérivés du plasma humain sur les surfaces internes de certains matériels de perfusion peut être responsable de l'échec du traitement.
MODALITÉS DE CONSERVATION |
-
Durée de conservation :
- 2 ans.
A conserver à une température ne dépassant pas 25 °C. Ne pas congeler.
-
Après reconstitution :
- Une utilisation immédiate est recommandée. Toutefois, la stabilité a été démontrée pendant 3 heures à 25 °C.
MODALITÉS MANIPULATION/ÉLIMINATION |
Ne jamais utiliser les flacons dès la sortie du réfrigérateur et respecter les règles d'asepsie habituelles.
Ne pas utiliser le dispositif de transfert sans aiguille si l'emballage stérile ou le conditionnement est abîmé ou montre des signes de détérioration.
-
Administration :
- Utiliser une technique aseptique.
- Il est recommandé de commencer l'administration dans les 3 heures suivant la reconstitution. Le matériel reconstitué ne doit pas être réfrigéré.
- Agiter doucement jusqu'à dissolution complète. S'assurer que Feiba est entièrement dissous, afin d'éviter que la substance active soit retenue par le filtre de Baxject II Hi-Flow.
- Après reconstitution, la solution devra être examinée pour vérifier l'absence de particules et/ou de coloration anormale.
- La solution est claire ou légèrement opalescente.
- Ne pas utiliser de solution trouble ou contenant un dépôt.
- Ne pas dépasser la vitesse d'injection de 2 unités Feiba/kg/minute.
- Si des dispositifs autres que ceux fournis devaient être utilisés, s'assurer de l'utilisation d'un filtre ayant des pores d'au moins 149 µm.
-
Instructions pour la reconstitution de Feiba avec Baxject II Hi-Flow :
- Amener le flacon de solvant (eau pour préparations injectables) à température ambiante (15 °C - 25 °C).
- Enlever les capsules des flacons de poudre et de solvant et nettoyer les bouchons. Placer les flacons sur une surface plane.
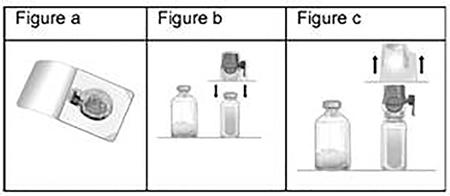
- Ouvrir l'emballage de Baxject II Hi-Flow en retirant l'opercule sans toucher l'intérieur (fig. a). Ne pas retirer le dispositif de l'emballage.
- Retourner l'emballage vers le bas et insérer la pointe en plastique transparent dans le bouchon du flacon de solvant (fig. b). Saisir l'emballage par les rebords puis retirer l'emballage de Baxject II Hi-Flow (fig. c).
Ne pas retirer le bouchon bleu de Baxject II Hi-Flow.
- Retourner le flacon de solvant connecté à Baxject II Hi-Flow sur lui-même, de sorte que le flacon de solvant se trouve en haut.
Insérer la pointe en plastique violet dans le bouchon du flacon de Feiba. Le vide va aspirer le solvant dans le flacon de Feiba (fig. d).
- Agiter doucement jusqu'à dissolution complète sans secouer. S'assurer que Feiba est entièrement dissous, afin d'éviter que la substance active soit retenue par le filtre du dispositif.
-
Instructions pour l'injection/la perfusion :
-
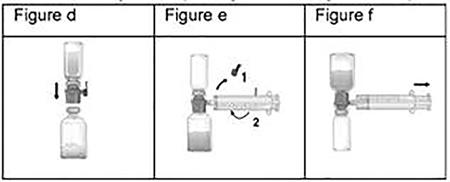
- Retirer le bouchon bleu de Baxject II Hi-Flow. Prendre la seringue et la connecter fermement à Baxject II Hi-Flow (ne pas aspirer d'air dans la seringue) (fig. e). De façon à s'assurer d'une connexion hermétique entre la seringue et Baxject II Hi-Flow, l'utilisation d'une seringue luer-lock est fortement recommandée (tourner la seringue dans le sens des aiguilles d'une montre jusqu'à la position de blocage).
- Retourner le système (la solution dissoute de flacon de Feiba désormais en haut). Remplir la seringue de solution reconstituée de Feiba en tirant doucement le piston en arrière et s'assurer que la connexion hermétique entre Baxject II Hi-Flow et la seringue est maintenue tout au long du transfert de la solution vers la seringue (fig. f).
- Retirer la seringue.
- Si de la mousse se forme dans la seringue, attendre jusqu'à ce qu'elle se réduise. Injecter lentement par voie intraveineuse à l'aide du nécessaire d'injection (ou aiguille à usage unique).
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
LISTE I
| Médicament soumis à prescription hospitalière. |
| AMM | 3400955055174 (2018, RCP rév 10.04.2024) 500 U/10 ml. |
| 3400956451500 (2000, RCP rév 10.04.2024) 1000 U/20 ml. |
| 3400955055181 (2018, RCP rév 10.04.2024) 2500 U/50 ml. |
| Collect. |
| Prix de cession et tarif de responsabilité (HT) par UCD : |
| UCD 3400894386087 (flacon à 500 U) : 417,406 euros. |
| UCD 3400892590820 (flacon à 1000 U) : 834,813 euros. |
| UCD 3400894386148 (flacon à 2500 U) : 2087,031 euros. |
| Inscrit sur la liste de rétrocession avec prise en charge à 100 %. Inscrit sur la liste des spécialités prises en charge en sus des GHS. |
Titulaire de l'AMM : Baxalta Innovations GmBH, Industriestrasse 67, A-1221 Vienne, Autriche.