Veuillez saisir au moins 3 caractères pour votre recherche.
- Médicaments
- MIOCHOLE
- MIOCHOLE 20 mg pdre/solv p sol IO
Mise à jour : 27 mars 2023
Sommaire
SYNTHÈSE |
excipient du solvant : sodium acétate trihydrate, magnésium chlorure hexahydrate, potassium chlorure, calcium chlorure dihydrate, eau ppi
Cip : 3400956768257
Modalités de conservation : Avant ouverture : < 25° durant 24 mois (Ne pas congeler)
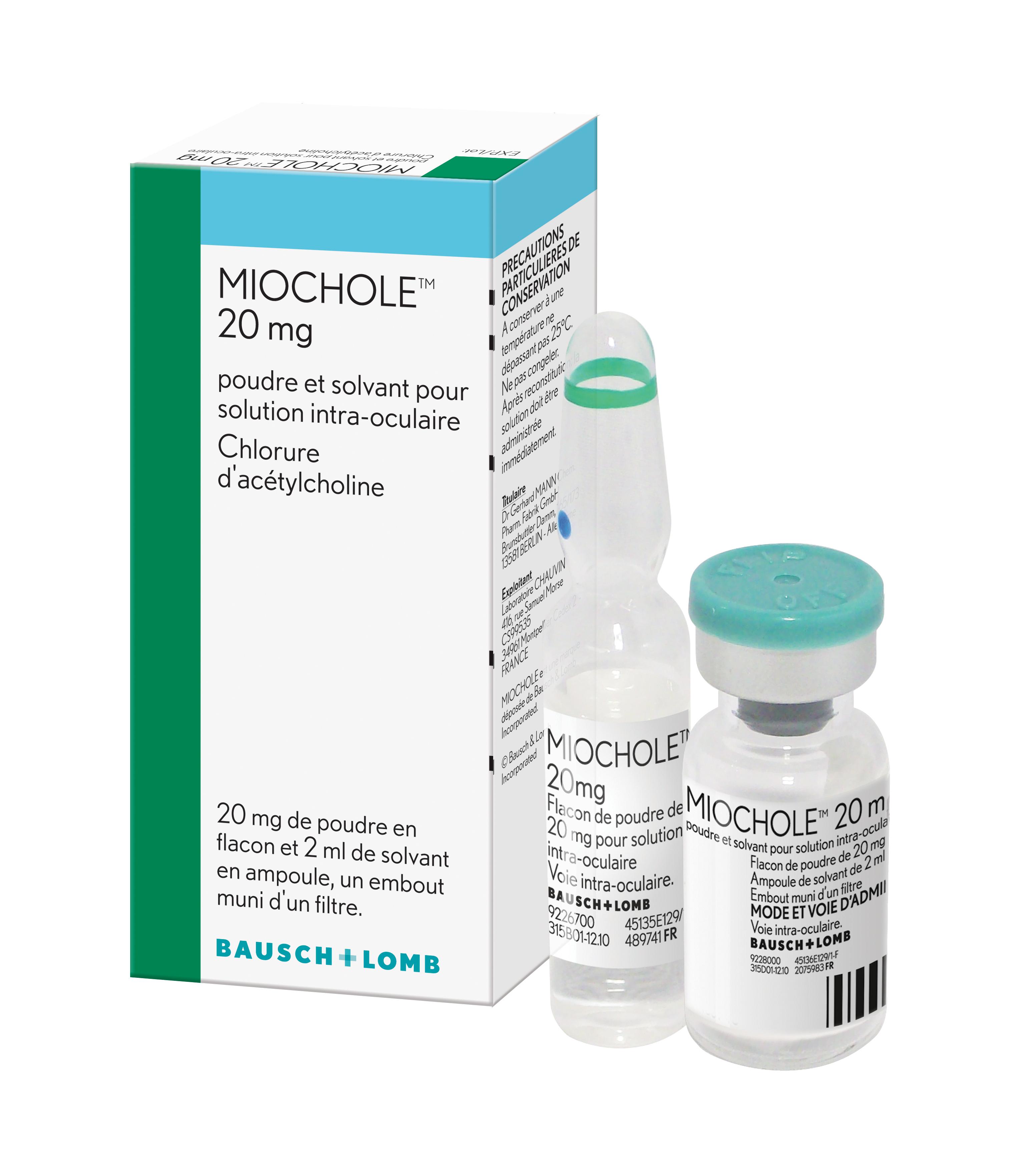
FORMES et PRÉSENTATIONS |
COMPOSITION |
| Poudre : | par flacon |
| Acétylcholine chlorure | 20 mg |
Solvant : acétate de sodium trihydraté, chlorure de magnésium hexahydraté, chlorure de potassium, chlorure de calcium dihydraté, eau pour préparations injectables.
INDICATIONS |
POSOLOGIE ET MODE D'ADMINISTRATION |
Connectez-vous pour accéder à ce contenu
CONTRE-INDICATIONS |
Connectez-vous pour accéder à ce contenu
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
Avant toute administration, les obstacles anatomiques susceptibles de s'opposer à l'obtention d'un myosis, comme les synéchies antérieures ou postérieures, doivent être recherchés.
Lors de la chirurgie de la cataracte, ne pas utiliser avant l'insertion de la lentille intraoculaire.
L'utilisation de ce médicament est déconseillée au cours de la grossesse (cf Grossesse/Allaitement).
Précautions d'emploi :S'assurer de l'intégrité du conditionnement avant utilisation.
Les conditions d'asepsie seront respectées à l'ouverture du blister.
Ne pas restériliser.
L'aspiration à travers l'embout de filtre n'est pas recommandée. Cependant, si c'est le cas, jeter l'aiguille de la seringue et l'embout de filtre afin d'éviter toute contamination de la solution pendant l'injection.
L'embout de filtre doit être utilisé seulement avec la solution de Miochole.
Ne pas aspirer et injecter en se servant du même embout de filtre.
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Compte tenu des données disponibles, l'utilisation de l'acétylcholine en solution intraoculaire est déconseillée au cours de la grossesse quel qu'en soit le terme, sauf en cas de nécessité absolue. En effet, les données cliniques et animales sont insuffisantes et ne permettent pas de conclure.
Le passage de l'acétylcholine dans le lait maternel est inconnu. Compte tenu du profil d'effets indésirables, il est préférable, par mesure de prudence, d'éviter d'allaiter lors de traitement par Miochole.
CONDUITE et UTILISATION DE MACHINES |
EFFETS INDÉSIRABLES |
Connectez-vous pour accéder à ce contenu
SURDOSAGE |
En cas de surdosage, le sulfate d'atropine (0,5 à 1 mg) peut être injecté par voie intramusculaire ou intraveineuse.
L'adrénaline (0,1 à 1 mg) peut être utilisée en cas de réactions cardiovasculaires ou bronchoconstrictrices sévères.
PHARMACODYNAMIE |
Connectez-vous pour accéder à ce contenu
PHARMACOCINÉTIQUE |
Connectez-vous pour accéder à ce contenu
SÉCURITÉ PRÉCLINIQUE |
La tolérance et la toxicité oculaire locale du chlorure d'acétylcholine ont été étudiés et aucune toxicité oculaire ni effet indésirable n'ont été mis en évidence. Aucune étude sur le potentiel mutagène, cancérogène ou tératogène n'est disponible.
INCOMPATIBILITÉS |
L'embout de filtre doit être utilisé seulement avec la solution de Miochole.
MODALITÉS DE CONSERVATION |
A conserver à une température ne dépassant pas 25 °C. Ne pas congeler.
MODALITÉS MANIPULATION/ÉLIMINATION |
Pas d'exigences particulières.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| Médicament réservé à l'usage hospitalier. |
| AMM | 3400956768257 (2006, RCP rév 08.02.2023). |
| Collect. |
.jpg)