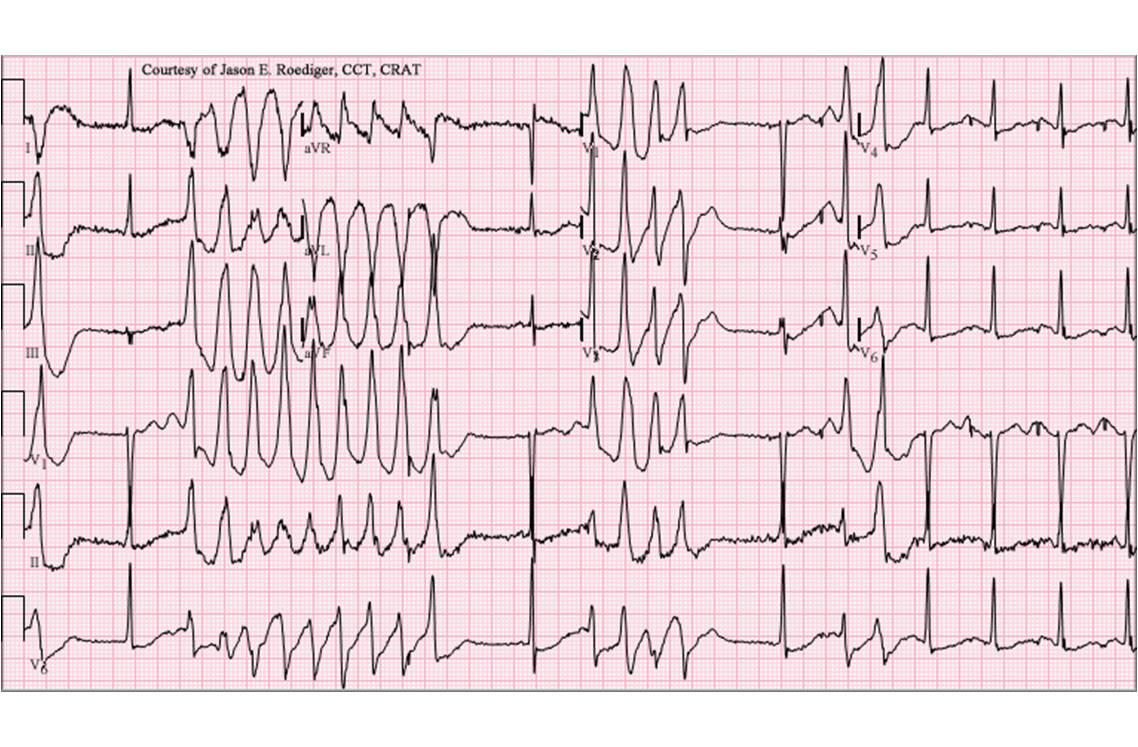
Electrocardiogramme montrant un allongement des espaces QT et captant des torsades de pointe (image : @ Jer5150, Wikimedia).
En mars 2013, la persistance des effets indésirables cardiaques (allongement de l'espace QT et arythmies ventriculaires) observés chez des patients traités par dompéridone a conduit les autorités européennes à réévaluer le rapport bénéfice/risque de ce principe actif.
En juillet 2013, le PRAC (comité pour l'Evaluation des Risques en matière de Pharmacovigilance) a communiqué ses premières conclusions sur la dompéridone, recommandant la mise en place de mesures de minimisation des risques de toxicité cardiovasculaire. Les conclusions définitives sont attendues pour mars 2014.
Dans l'attente, l'ANSM (Agence nationale de sécurité du médicament et des produits de santé) rappelle aux prescripteurs les modalités de bon usage de la dompéridone :
En juillet 2013, le PRAC (comité pour l'Evaluation des Risques en matière de Pharmacovigilance) a communiqué ses premières conclusions sur la dompéridone, recommandant la mise en place de mesures de minimisation des risques de toxicité cardiovasculaire. Les conclusions définitives sont attendues pour mars 2014.
Dans l'attente, l'ANSM (Agence nationale de sécurité du médicament et des produits de santé) rappelle aux prescripteurs les modalités de bon usage de la dompéridone :
- respecter strictement les indications des médicaments à base de dompéridone ;
- prendre en compte le risque cardiaque, dont l'allongement de l'intervalle QT, en particulier chez les patients qui présentent des facteurs de risque (allongement existant de l'intervalle QT, troubles électrolytiques importants, insuffisance cardiaque congestive, etc) ;
- limiter la prescription à la durée de traitement la plus courte (usuellement 7 jours maximum) et à la dose la plus faible possible ;
- ne pas dépasser 30 mg/jour chez l'adulte.
Le risque d'effets indésirables cardiaques peut être plus élevé chez les patients âgés de plus de 60 ans ou chez ceux qui sont traités par des doses quotidiennes supérieures à 30 mg.
L'ANSM recommande de reconsidérer l'utilité de toute nouvelle prescription de dompéridone.
En l'absence de troubles cardiaques, les patients actuellement sous traitement peuvent continuer la prise de dompéridone.
Pour mémoire
En France, la dompéridone entre dans la composition des médicaments suivants : MOTILIUM, PERIDYS et génériques, BIPERIDYS et BIPERIDYSFLASH. Ces médicaments sont sur prescription médicale.
La dompéridone est indiquée :
- chez l'adulte pour le soulagement des symptômes de type nausées et vomissements, sensations de distension épigastrique, gêne au niveau supérieur de l'abdomen et régurgitations gastriques ;
- chez l'enfant pour le soulagement des symptômes de type nausées et vomissements.
Sources et ressources complémentaires
Réévaluation en cours du rapport bénéfice/risque des spécialités à base de dompéridone - Point d'information (ANSM, 20 février 2014)
Mise en garde de l'ANSM sur l'utilisation des médicaments contenant de la dompéridone (ANSM, 20 février 2014)
A propos des médicaments à base de dompéridone - Questions / Réponses à destination des patients (ANSM, 20 février 2014)
A propos des médicaments à base de dompéridone - Questions / Réponses à destination des patients (ANSM, 20 février 2014)
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 2 minutes
2 minutes Ajouter un commentaire
Ajouter un commentaire






Commentaires
Cliquez ici pour revenir à l'accueil.