
Représentation en 3D d'un virus de l'hépatite C (illustration).
Nouvelle association fixe d'AAD dans le traitement de l'hépatite C chronique
ZEPATIER 50 mg/100 mg comprimé pelliculé est une nouvelle association fixe d'antiviraux d'action directe (AAD) disponible à l'hôpital pour le traitement de l'hépatite C chronique (HCC) chez les adultes (Cf. VIDAL Reco "Hépatite C").
Selon son autorisation de mise sur le marché (AMM), ZEPATIER est indiqué chez les patients ayant une hépatite C chronique de génotypes 1 et 4, sans ou avec cirrhose compensée (Child-Pugh A uniquement).
ZEPATIER se compose :
- de grazoprévir, un inhibiteur de la protéase NS3A / 4A, à la dose de 100 mg par comprimé,
- d'elbasvir, un inhibiteur de la polymérase NS5A, à la dose de 50 mg par comprimé.
Leurs mécanismes d'action distincts et leurs profils de résistance non chevauchants permettent de cibler le virus de l'hépatite C (VHC) à de multiples étapes du cycle de vie viral.
Nouvel AAD pour renforcer l'offre thérapeutique contre l'hépatite C
Actuellement, l'offre en AAD comprend, outre ZEPATIER :
- le sofosbuvir seul (SOVALDI) et en association avec le lédipasvir (HARVONI)
- le siméprévir (OLYSIO)
- le daclatasvir (DAKLINZA)
- le dasabuvir (EXVIERA)
- l'association paritaprévir, ombitasvir et ritonavir (VIEKIRAX)
Les schémas thérapeutiques préférentiels chez les patients naïfs, pour les génotypes couverts par les AMM sont représentés dans le tableau I.
Tableau I - Schémas thérapeutiques préférentiels chez les patients naïfs,
pour les génotypes couverts par les AMM
(extrait de l'avis de la Commission de la transparence du 19 octobre 2016)
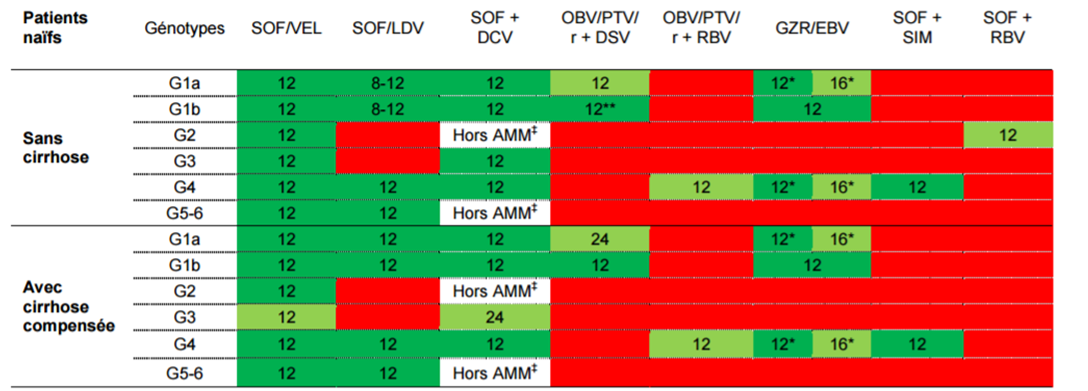 SOF : Sofosbuvir ; VEL : Velpatasvir ; SIM : Simeprevir ; DCV : Daclatasvir ; LDV : Ledipasvir ; OBV : Ombitasvir ; PTV : Paritaprevir ; r : ritonavir ; DSV : Dasabuvir ; RBV : ribavirine ; GZR: Grazoprévir ; EBV : Elbasvir SOF : Sofosbuvir ; VEL : Velpatasvir ; SIM : Simeprevir ; DCV : Daclatasvir ; LDV : Ledipasvir ; OBV : Ombitasvir ; PTV : Paritaprevir ; r : ritonavir ; DSV : Dasabuvir ; RBV : ribavirine ; GZR: Grazoprévir ; EBV : Elbasvir  * Impact du polymorphisme NS5A et/ou charge virale (CV) > 800 000 UI/mL chez les patients GT1a nécessitant une prolongation de la durée de traitement à 16 S +RBV. Les patients sans VAR NS5A préexistant et ayant une CV < 800 000 UI/mL peuvent bénéficier d'un traitement de 12 semaines sans ribavirine. * Impact du polymorphisme NS5A et/ou charge virale (CV) > 800 000 UI/mL chez les patients GT1a nécessitant une prolongation de la durée de traitement à 16 S +RBV. Les patients sans VAR NS5A préexistant et ayant une CV < 800 000 UI/mL peuvent bénéficier d'un traitement de 12 semaines sans ribavirine. ** Une durée de traitement de 8 semaines peut être envisagée (EASL 2016), mais hors AMM. ‡ Un traitement de 12 semaine sans ribavirine peut être envisagé (EASL 2016), mais hors AMM. |
Dans ses recommandations du 7 décembre 2016, la Commission de la transparence prenait en compte l'efficacité virologique importante des AAD, supérieure à 90 % dans la plupart des groupes de patients, avec un bon profil de tolérance et des durées nécessaires de traitement variant de 8 à 24 semaines, selon les cas.
Elle estimait que les AAD, dont ZEPATIER, devait désormais être proposés à l'ensemble des patients infectés par le VHC, y compris les porteurs asymptomatiques ayant un stade de fibrose F0 ou F1 qui ne sont pas à risque de transmission du VHC.
Une efficacité importante > 90 %
Pour évaluer l'efficacité de ZEPATIER, la Commission de la transparence s'est appuyée principalement sur 8 études conduites chez des patients infectés par un VHC de génotype 1, 4 ou 6 sans cirrhose ou avec cirrhose compensée (Cf. avis du 19 octobre 2016) :
- 3 études randomisées de phase III dont 1 étude versus sofosbuvir + PR (interféron pégylé/ribavirine) en ouvert chez des patients naïfs ou prétraités, 1 étude versus placebo (patients naïfs) en double insu, et 1 étude de comparaison en ouvert entre différents schémas thérapeutiques chez des patients en échec de PR ;
- 5 études réalisées chez des patients VHC particuliers (insuffisants rénaux chroniques, troubles hématologiques héréditaires, usagers de drogues ou co-infectés par le VIH).
Dans toutes ces études, le critère principal de jugement était la réponse virologique soutenue (RVS), définie par un ARN du VHC inférieur à la limite inférieure de quantification 12 semaines après la fin du traitement (RVS12).
Les résultats ont montré une efficacité importante de ZEPATIER, supérieure à 90 %, chez les patients infectés par un VHC de génotype 1 et 4, à 12 ou 16 semaines de traitement.
Chez les patients de type 1a ayant un taux d'ARN-VHC > 800 000 UI/ml et/ou des VAR de la NS5A préexistants ainsi que chez les patients de génotype 4 ayant un taux d'ARN-VHC > 800 000 UI/ml, l'adjonction de ribavirine et une durée de traitement de 16 semaines ont été nécessaires.
Le profil de tolérance a globalement été satisfaisant et comparable à celui des autres combinaisons à base de d'inhibiteurs de protéase actuellement disponibles (ombitasvir/paritaprévir/ritonavir + dasabuvir, ou sofosbuvir + siméprévir).
Fatigue et céphalées ont été les effets indésirables les plus fréquemment rapportés (> 10 %).
Place de ZEPATIER dans la stratégie thérapeutique
Sur la base des résultats obtenus dans les populations de génotypes 1 et 4, aux posologies de l'AMM, la Commission de la transparence a considéré que la place de ZEPATIER dans la stratégie thérapeutique est celle d'une option thérapeutique pour le traitement des patients ayant une hépatite C chronique de génotypes 1 et 4, sans ou avec cirrhose compensée (Child-Pugh A uniquement).
Comme les autres associations, ZEPATIER n'est pas recommandé chez les patients ayant une insuffisance hépatique modérée (Child-Pugh B) et est contre-indiqué chez les patients ayant une insuffisance hépatique (Child-Pugh C) en raison d'un risque de décompensation hépatique et d'insuffisance hépatique lors du traitement.
Tenant compte de l'ensemble des données disponibles, la Commission a jugé que le service médical rendu (SMR) par ZEPATIER est important dans la prise en charge des patients infectés par le VHC de génotypes 1 et 4, et qu'il apporte une amélioration du SMR mineure (ASMR IV) au même titre que les autres AAD disponibles (DAKLINZA, EXVIERA, HARVONI, OLYSIO, VIEKIRAX).
ZEPATIER en pratique : posologie et durée du traitement
La posologie recommandée de ZEPATIER est de 1 comprimé 1 fois par jour.
Les comprimés pelliculés doivent être avalés entiers et peuvent être pris au cours ou en dehors des repas.
La durée de traitement est généralement de 12 semaines (génotypes 1a, 1b et 4).
Pour certains patients de génotype 1a ou 4, la durée de traitement peut être étendue à 16 semaines, en association avec de la ribavirine afin de prévenir l'impact clinique des résistances virologiques (Cf. Tableau II).
Tableau II - Durée du traitement par ZEPATIER selon le profil virologique du patient
| Génotype VHC | Traitement et durée |
| 1a | ZEPATIER pendant 12 semaines Chez les patients avec un taux d'ARN-VHC initial > 800 000 UI/mL et/ou la présence de polymorphismes spécifiques de la NS5A entraînant une réduction d'au moins 5 fois de l'activité de l'elbasvir, la prise de ZEPATIER devrait être envisagée pendant 16 semaines avec de la ribavirine(a) afin de minimiser le risque d'échec au traitement (cf Pharmacodynamie). |
| 1b | ZEPATIER pendant 12 semaines |
| 4 | ZEPATIER pendant 12 semaines Chez les patients avec un taux d'ARN-VHC initial > 800 000 UI/mL, la prise de ZEPATIER devrait être envisagée pendant 16 semaines avec de la ribavirine(a) afin de minimiser le risque d'échec au traitement (cf Pharmacodynamie). |
Prendre en compte les traitements concomitants
Le traitement par ZEPATIER est contre-indiqué avec un certain nombre de médicaments influençant son métabolisme et se traduisant par une augmentation ou une diminution des concentrations plasmatiques :
- augmentation de la concentration plasmatique du grazoprevir avec les inhibiteurs du polypeptide 1B transportant des anions organiques (OATP1B), tels que la rifampicine, l'atazanavir, le darunavir, le lopinavir, le saquinavir, le tipranavir, le cobicistat ou la ciclosporine ;
- diminution de la concentration plasmatique de l'elbasvir et du grazoprevir avec les inducteurs du cytochrome P450 3A (CYP3A) ou de la P-glycoprotéine (P-gp), tels que l'efavirenz, la phénytoïne, la carbamazépine, le bosentan, l'étravirine, le modafinil ou le millepertuis (Hypericum perforatum). Ce dernier est présent dans des compléments alimentaires en vente sans ordonnance en pharmacie.
Surveillance pendant le traitement
La surveillance doit porter sur la fonction hépatique dont un bilan (taux d'ALAT) doit être réalisé avant l'initiation du traitement, à la 8e semaine de traitement, et dès lors que l'état clinique le justifie.
Les résultats de ce bilan déterminent la poursuite du traitement.
Les patients doivent être sensibilisés aux signes évocateurs d'une toxicité hépatique, comme une fatigue, une faiblesse, un manque d'appétit, des nausées et vomissements, un ictère ou des selles décolorées. En leur présence, les patients doivent consulter un médecin.
ZEPATIER fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.
Contraception pour la femme et pour l'homme
Lorsque ZEPATIER est administré en association avec la ribavirine, les femmes en âge de procréer ou leurs partenaires masculins doivent utiliser une méthode contraceptive efficace pendant le traitement et pendant une "certaine" durée après l'arrêt du traitement.
Périmètre de prise en charge de ZEPATIER
La prise en charge de ZEPATIER est accordée dans le traitement de l'infection chronique par le virus de l'hépatite C de génotypes 1 et 4 chez les adultes.
Cette prise en charge est conditionnée : l'initiation du traitement est subordonnée à la tenue d'une réunion de concertation pluridisciplinaire uniquement pour les patients suivants :
- en échec d'un premier traitement par antiviraux d'action directe ;
- insuffisants rénaux (si le débit de filtration glomérulaire est inférieur à 30 mL/min), hémodialysés chroniques ou transplantés rénaux ;
- ayant une cirrhose grave, compliquée MELD > 18 ou avec facteurs d'aggravation ou ayant des antécédents de cirrhose grave ;
- en pré ou post-transplantation hépatique ;
- ayant un carcinome hépatocellulaire ou un antécédent de carcinome hépatocellulaire ;
- co-infectés par le VIH, le VHB ou un autre virus à tropisme hépatique ;
- dont l'état de santé ou le traitement peuvent interférer avec la prise en charge de l'hépatite C.
Un prix inférieur aux autres AAD
ZEPATIER est vendu au prix de 28 732 euros (avant remises) pour 12 semaines de traitement (prix ou tarif de responsabilité HT par UCD = 342,050 euros).
Suite aux négociations entre le CEPS (comité économique des produits de santé) et le laboratoire, Marisol Touraine s'est félicitée de cet accord en décembre dernier, soulignant que "le prix de ce médicament était inférieur de près de 38 % à celui des autres médicaments contre l'hépatite C actuellement disponibles sur le marché" (communiqué de presse du 8 décembre 2016).
Identité administrative
- Liste I
- Prescription hospitalière réservée aux spécialistes en gastro-entérologie et hépatologie, en médecine interne ou en infectiologie
- Boîte de 28, CIP 3400930061701, UCD 3400894180081
- Mode de prise en charge (Cf. Conditions Infra)
- Agrément aux collectivités (Journal officiel du 4 janvier 2017 - Texte 8)
- Inscrit sur la liste de rétrocession avec prise en charge à 100 % (Journal officiel du 6 janvier 2017 - Texte 29)
- Laboratoire MSD France
Pour aller plus loin
Avis de la Commission de la transparence (HAS, 19 octobre 2016)
Sur VIDAL.fr
Antiviraux d'action directe contre l'hépatite C : extension du remboursement (13 juin 2016)
Hépatite C : les indications des antiviraux d'action directe vont bientôt être étendues à tous les patients atteints (30 mai 2016)
DAKLINZA, OLYSIO, HARVONI : agrément aux collectivités et modalités de remboursement (6 mai 2015)
Hépatite C chronique et comorbidités : quelles stratégies thérapeutiques ? (janvier 2015)
Stratégie thérapeutique dans l'hépatite C : les recommandations de la HAS (juillet 2014)
Pour aller plus loin
Consultez les monographies VIDAL
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 8 minutes
8 minutes Ajouter un commentaire
Ajouter un commentaire.png)




Commentaires
Cliquez ici pour revenir à l'accueil.