
Les contractures musculaires douloureuses ont le plus souvent une origine rachidienne et, parmi elles, les plus fréquentes sont les lombalgies (illustration).
COLTRAMYL et génériques déremboursés à partir du 2 janvier 2018
A partir du 2 janvier 2018, les spécialités myorelaxantes orales de thiocolchicoside ne seront plus prises en charge par l'Assurance maladie, ni en ville, ni à l'hôpital.
Deux arrêtés ministériels publiés au Journal officiel du 29 novembre 2017 (texte 14 et texte 15) ont officialisé ces radiations qui concernent une trentaine de spécialités (Cf. Encadré 1) dont près d'une dizaine ne sont déjà plus commercialisées.
Encadré 1 - Spécialités de thiocolchicoside radiées du remboursement au 2 janvier 2018
|
Une surveillance renforcée depuis 2014
Le thiocolchicoside per os est indiqué dans le traitement d'appoint des contractures musculaires douloureuses en pathologie rachidienne aiguë chez les adultes et les adolescents à partir de 16 ans (Cf. VIDAL Reco "Lombalgie aiguë").
Il s'agit d'un dérivé de la colchicine, commercialisé en France depuis plus de 50 ans.
Le thiocolchicoside existe également sous forme injectable (non remboursable).
En 2014, la Commission européenne a décidé une restriction de l'indication, de la posologie maximale (8 mg toutes les 12 heures par voie orale) et de la durée d'utilisation (inférieure ou égale à 7 jours consécutifs pour la voie orale) des spécialités de thiocolchicoside en raison d'un risque d'aneuploïdie (altération de la mitose cellulaire et variation du nombre de chromosome) (notre article du 3 avril 2014). Cette toxicité serait liée à un métabolite du thiocolchicoside.
En outre, les contre-indications ont été étendues aux femmes en âge de procréer sans contraception efficace.
Suite à ces mesures de réduction du risque génotoxique, la surveillance nationale a été renforcée.
Un SMR insuffisant : peu de bénéfices, des risques de toxicité cellulaire et des alternatives thérapeutiques
La décision de radiation s'appuie sur l'avis de la Commission de la transparence du 20 juillet 2016, émis à l'occasion du renouvellement d'inscription.
En 1999 déjà, lors de la réévaluation de ces médicaments par la Commission de la transparence, un SMR (service médical rendu) faible leur avait été attribué suivi, en 2010, d'un taux de remboursement de 15 %.
Lors de leur réévaluation en 2016, la Commission a conclu à un intérêt clinique insuffisant dans la prise en charge des contractures musculaires douloureuses associées aux lombalgies aiguës en raison :
- d'une efficacité au mieux modeste,
- du risque d'aneuploïdie reconnu comme un facteur potentiel de risque de cancer et de tératogénicité, d'embryotoxicité/d'avortements spontanés et de baisse de la fertilité masculine,
- des autres risques associés, dont les réactions d'hypersensibilité, les réactions cutanées, ou les troubles gastro-intestinaux ou neuro-psychiques,
- de l'existence d'alternatives (Cf. Figure 1).
Figure 1 - Stratégie de prise en charge des lombalgies aiguës
(d'après VIDAL Recos "Prise en charge - Lombalgie aiguë")
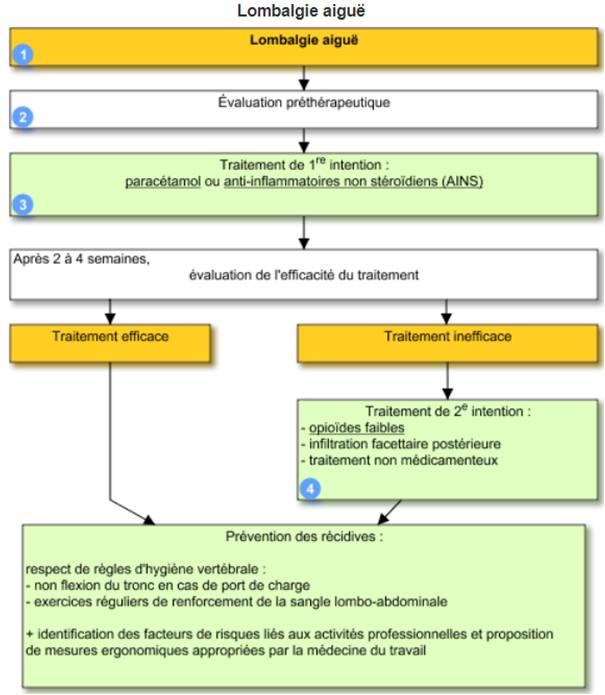
(d'après VIDAL Recos "Prise en charge - Lombalgie aiguë")

Pour aller plus loin
Arrêté du 24 novembre 2017 portant radiation des spécialités orales de thiocolchicoside de la liste des spécialités remboursables (Journal officiel du 29 novembre 2017 - texte 14)
Arrêté du 24 novembre 2017 portant radiation des spécialités orales de thiocolchicoside de la liste des médicaments agréés à l'usage des collectivités (Journal officiel du 29 novembre 2017 - texte 15)
Avis de la Commission de la transparence applicable à COLTRAMYL et ses génériques (HAS, 20 juillet 2016)
Synthèse d'avis de la Commission de la transparence - COLTRAMYL et génériques (HAS, juillet 2016)
Sur VIDAL.fr
Spécialités à base de thiocolchicoside : AMM modifiées en raison du risque de génotoxicité (3 avril 2014)
Pour aller plus loin
Consultez les monographies VIDAL
Consultez les VIDAL Recos
Pour recevoir gratuitement toute lãactualitûˋ par mail Je m'abonne !

 4 minutes
4 minutes Ajouter un commentaire
Ajouter un commentaire






Commentaires
Cliquez ici pour revenir à l'accueil.