
La crise de goutte touche le plus souvent le gros orteil, dans 56 à 78 % des cas lors de la première crise (illustration).
De nouvelles données de sécurité d'emploi du fébuxostat (ADENURIC et générique : cf. Encadré 1) sont communiquées aux professionnels de santé par l'ANSM (Agence nationale de sécurité du médicament et des produits de santé) :
"Le traitement par fébuxostat chez des patients présentant une maladie cardiovasculaire majeure préexistante (par ex. infarctus du myocarde, accident vasculaire cérébral ou angor instable) doit être évité, sauf si aucune autre option thérapeutique n'est appropriée".
Encadré 1 - Indication thérapeutique du fébuxostat (ADENURIC et génériques)
| Indiqué chez l'adulte (Cf. VIDAL Reco "Goutte"). Dosages à 80 mg et à 120 mg :
|
Une mortalité accrue dans le groupe fébuxostat versus allopurinol
Ces recommandations font suite aux résultats observés dans l'étude de phase IV CARES (N Engl J Med 2018). Cette étude américaine multicentrique (Etats-Unis, Canada, Mexique) de non infériorité visait à étudier la sécurité cardiovasculaire du fébuxostat et de l'allopurinol chez des patients atteints de goutte et de comorbidités cardiovasculaires majeures.
Six mille cent quatre vingt dix patients ont été inclus et randomisés en double aveugle dans le groupe fébuxostat (n = 3 098) ou le groupe allopurinol (n = 3092). La durée de suivi moyen a été de 32 mois et la durée moyenne d'exposition de 728 jours (fébuxostat) et 719 jours (allopurinol).
Le critère d'évaluation principal était le délai de survenue du premier événement cardio-vasculaire majeur (MACE), un composite d'infarctus du myocarde non fatals, de décès de cause cardiovasculaire et d'angor instable avec une revascularisation coronaire en urgence.
L'analyse des composants individuels de MACE (critères d'évaluation secondaire) montre :
- un taux de décès CV significativement plus élevé dans le groupe fébuxostat versus allopurinol (4,3 % versus 3,2 % - HR : 1,34 ; IC 95 % : 1,03-1,73) [Cf. Figure 1] ;
Figure 1 - Taux de décès cardiovasculaire - Courbes de Kaplan Meier
(extrait de l'étude CARES, N Engl J Med 2018)
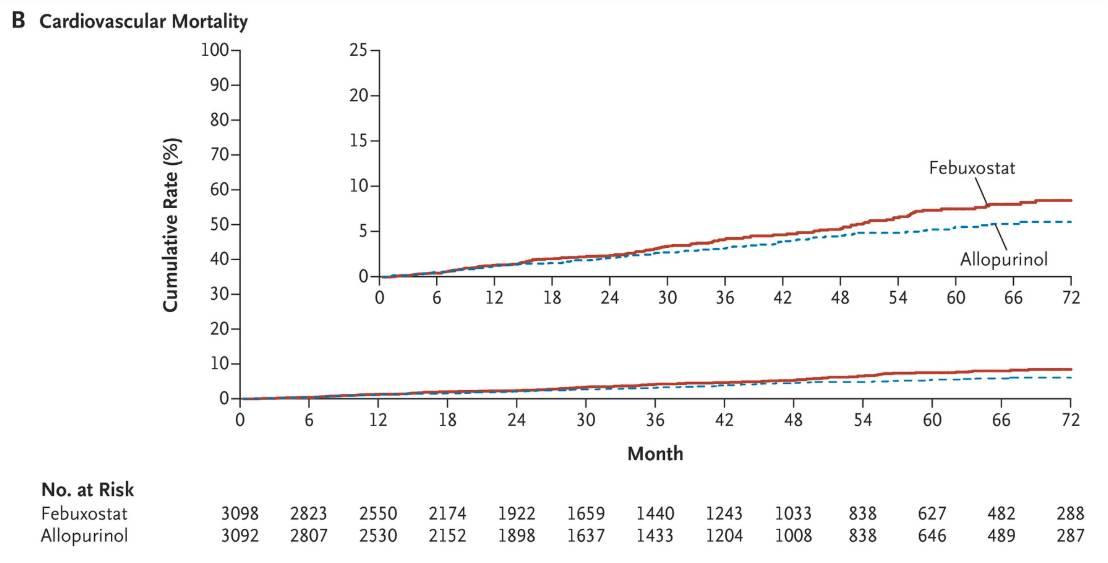
- un taux de mortalité toutes causes confondues significativement plus élevé dans le groupe fébuxostat versus allopurinol (7,8 % versus 6,4 % - HR 1,22 ; IC 95 % : 1,01-1,47) [Cf. Figure 2];
Figure 2 - Mortalité toutes causes - Courbes de Kaplan Meier
(extrait de l'étude CARES, N Engl J Med 2018)

- Des taux similaires pour les autres événements MACE :
- Infarctus du myocarde non fatals : 3,6 % pour le fébuxostat, 3,8 % pour l'allopurinol.
- AVC non fatals : 2,3 % pour le fébuxostat et l'allopurinol.
- Revascularisation en urgence due à un angor instable : 1,6 % pour le fébuxostat, 1,8 % pour l'allopurinol.
Sécurité du fébuxostat : une étude européenne en cours (FAST)
En complément de l'étude CARES, les autorités de santé européennes ont lancé l'étude FAST (febuxostat versus allopurinol streamlined tried) pour évaluer le profil de sécurité du fébuxostat versus allopurinol chez des patients présentant une hyperuricémie symptomatique chronique et un facteur de risque cardiovasculaire.
Les résultats de cette étude sont attendus avant le deuxième trimestre 2020.
Pour aller plus loin
Fébuxostat : risque accru, chez les patients traités par fébuxostat et présentant des antécédents de maladie cardiovasculaire majeure, de mortalité cardiovasculaire et de mortalité toutes causes confondues (étude CARES) (ANSM, 12 juillet 2019)
Lettre des laboratoires aux professionnels de santé - Fébuxostat et risque accru de mortalité cardiovasculaire et de mortalité toutes causes confondues (étude CARES) - Lettre aux professionnels de santé (sur le site de l'ANSM, juillet 2019)
Les études sur le profil de sécurité du fébuxostat
Etude CARES :
White WB, Saag KG, Becker MA, et al. CARES investigators. Cardiovascular safety of febuxostat or allopurinol in patients with gout. NEngl J Med. 2018
Etude FAST :
MacDonald TM, Ford I, Nuki G, Mackenzie IS, De Caterina R, Findlay E, et al. Protocol of the Febuxostat versus Allopurinol Streamlined Trial (FAST): a large prospective, randomised, open, blinded endpoint study comparing the cardiovascular safety of allopurinol and febuxostat in the management of symptomatic hyperuricaemia. BMJ Open 2014
Pour aller plus loin
Consultez les monographies VIDAL
- ADENURIC 120 mg cp pellic
- ADENURIC 80 mg cp pellic
- FEBUXOSTAT ACCORD 120 mg cp pellic
- FEBUXOSTAT ACCORD 80 mg cp pellic
- FEBUXOSTAT ARROW 120 mg cp pellic
- FEBUXOSTAT ARROW 80 mg cp pellic
- FEBUXOSTAT SANDOZ 120 mg cp pellic
- FEBUXOSTAT SANDOZ 80 mg cp pellic
- FEBUXOSTAT TEVA SANTE 120 mg cp pellic
- FEBUXOSTAT TEVA SANTE 80 mg cp pellic
- FEBUXOSTAT ZENTIVA LAB 120 mg cp pellic
- FEBUXOSTAT ZENTIVA LAB 80 mg cp pellic
Consultez les VIDAL Recos
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 3 minutes
3 minutes Ajouter un commentaire
Ajouter un commentaire






Commentaires
Cliquez ici pour revenir à l'accueil.