
Représentation en 3D de l'interaction entre une cellule CAR T et une cellule cancéreuse (illustration).
YESCARTA (axicabtagène ciloleucel) est une immunothérapie constituée de cellules T autologues génétiquement modifiées, dirigées contre le CD19.
Ce nouveau médicament de thérapie génique est indiqué dans le traitement des patients adultes atteints de lymphome diffus à grandes cellules B (LDGCB) et de lymphome médiastinal primitif à grandes cellules B (LMPGCB) réfractaire ou en rechute, après au moins deux lignes de traitement systémique (Cf. VIDAL Reco "Lymphome non hodgkinien ganglionnaire de l'adulte").
YESCARTA dispose d'une AMM (autorisation de mise sur le marché) européenne, avec le statut de médicament orphelin.
Avant la commercialisation effective en France (juillet 2019), YESCARTA a bénéficié d'une ATU (autorisation temporaire d'utilisation) de cohorte en juillet 2018.
YESCARTA se présente en poche de cryoconservation de 68 mL, contenant une dispersion cellulaire. Chaque poche de cryoconservation est emballée individuellement dans une cassette de transport.
 YESCARTA fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté.
YESCARTA fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté.YESCARTA : une immunothérapie à visée autologue
YESCARTA est un médicament de thérapie génique, préparé pour un patient unique à partir de ses cellules T autologues. Il est utilisé en troisième ligne de traitement, chez des patients adultes réfractaires ou en rechute.
Après leur prélèvement par leucaphérèse, les cellules T sont génétiquement modifiées ex vivo pour exprimer un récepteur chimérique à l'antigène (CAR) ciblant la protéine CD19 présente sur les cellules de la lignée B.
Après cette étape de préparation, chaque poche de YESCARTA contient une dose de cellules CAR T anti-CD19 viables.
Le mode d'action des cellules CAR T anti-CD19 repose sur leur capacité à se lier avec les cellules cibles exprimant le CD19, c'est-à-dire des cellules cancéreuses et des lymphocytes B normaux. Les domaines de co-stimulation CD28 et CD3-zéta activent la cascade de signalisation qui conduit à l'activation, la prolifération, l'acquisition de fonctions effectrices et la sécrétion des cytokines et des chimiokines inflammatoires. Cette cascade d'événements conduit à l'apoptose et à la nécrose des cellules cibles exprimant le CD19.
Dans son avis du 5 décembre 2018, la Commission de la Transparence de la HAS a évalué YESCARTA sur la base principalement d'une étude américaine de phase II non comparative, ZUMA-1 (Neelapu SS et coll. N Engl J Med 2017) dont le schéma est décrit dans la figure 1 ci-dessous.
Figure 1 - Schéma de l'étude ZUMA-1 (extrait de l'avis de la Commission de la Transparence)
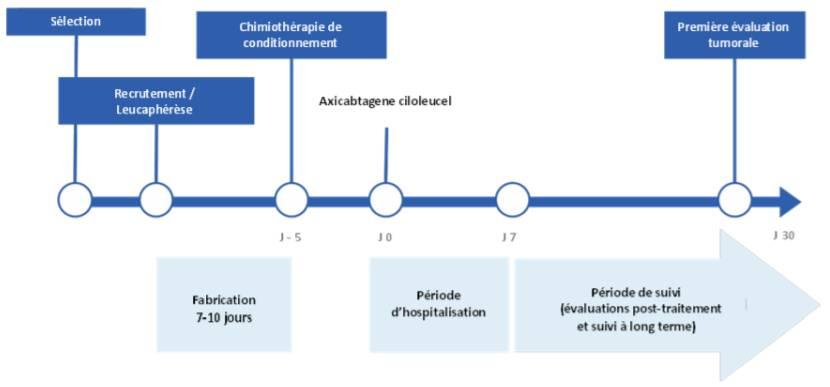
Le critère de jugement principal était le pourcentage de réponses objectives défini par la somme des réponses partielles et complètes mesurées par PET Scan (tomographie par émission de positons).
Au total, 111 patients ont été inclus dans cet essai, et 101 ont reçu YESCARTA. Les patients avaient un LDGCB (76 %), un LMPGCB (8 %) ou un lymphome folliculaire transformé (16 %) le plus souvent à un stade avancé. Ils étaient réfractaires à une seconde ligne de traitement ou plus (77 %), ou en rechute dans les 12 mois suivant une autogreffe (21 %).
Au terme d'un suivi médian de 8,7 mois, le pourcentage de réponse objective a été de 71 % (72/101) parmi les patients effectivement traités par YESCARTA (101/111), dont 51 % avec une réponse complète.
La médiane de survie globale, critère le plus pertinent à ce stade de la maladie selon la Commission de la transparence, n'a pas été atteint chez 101 patients traites par YASCARTA ; elle a été de 17,4 mois en prenant en compte les patients ayant eu une leucaphérèse. Les probabilités de survie globale ont été estimées à 59 % à 12 mois et 49 % à 18 mois.
La Commission de la Transparence considère que, si les données d'efficacité sont pertinentes à court terme sur le critère de réponse complète (1 patient sur 2 présente une réponse complète au traitement) et sur la survie globale dans des situations cliniques engageant le pronostic vital, d'autres études sont attendues pour évaluer l'efficacité et la sécurité de YESCARTA à long terme et pour comparer cette efficacité aux traitements disponibles tels l'allogreffe en consolidation de la chimiothérapie, diverses chimiothérapies (dont PIXUVRI) ou KYMRIAH, un autre médicament de thérapie génique à base de cellules T CAR ayant obtenu son AMM en 2018].
Tolérance de YESCARTA : une toxicité significative
Selon l'étude ZUMA-1, 1 patient sur 2 traité par YESCARTA a présenté un événement indésirable grave. Trois décès ont été rapportés.
Le profil de tolérance de YESCARTA est marqué par :
- le syndrome de relargage cytokinique (93 % dont 13 % de grades >= 3) avec 43 % des patients qui ont nécessité l'utilisation d'un traitement anti-cytokine tel que le tocilizumab et/ou des corticostéroïdes (27 %),
- des effets indésirables neurologiques de grades >= 3 dans près d'un tiers des cas (28 %),
- des cytopénies (rapportées chez 89 % des patients avec 77 % de grades >= 3 (grade 3 : 35 %, grade 4 : 41 % et grade 5 : 1 %),
- des neutropénies fébriles observées chez un tiers des patients,
- des infections de grades >= 3 chez près d'un quart des patients (22 %),
- et une hypogammaglobulinémie chez 19 % des patients (19/101) et supplémentation en immunoglobulines pour 6 patients (6%).
SMR important, ASMR modérée
Au terme de son évaluation, sur la base des données disponibles, la Commission de la Transparence estime que YESCARTA apporte un service médical rendu (SMR) important et une amélioration du SMR modérée (ASMR III) en termes d'efficacité par rapport à la prise en charge actuelle du lymphome diffus à grandes cellules B et du lymphome médiastinal primitif à grandes cellules B réfractaire ou en rechute, après au moins deux lignes de traitement systémique.
Cet avis tient compte :
- "des données d'efficacité pertinentes obtenues à court terme sur la réponse complète (environ 50% de la population ITT) et sur la survie globale dans des situations cliniques engageant le pronostic vital et pour lesquelles les options thérapeutiques sont limitées et ne permettent pas d'envisager une rémission,
- des incertitudes sur la quantité d'effet faute de comparaison directe à la prise en charge habituelle, et sur le maintien de l'efficacité clinique à plus long terme,
- de la toxicité significative à court terme et de l'absence de donnée de tolérance à long terme."
L'usage de YESCARTA doit répondre aux exigences suivantes :
- qualification de l'établissement de santé : il convient notamment de disposer du tocilizumab et d'un équipement d'urgence avant la perfusion et pendant la période de surveillance. L'établissement doit également être en capacité de stocker YESCARTA (congélation) ;
- instauration et supervision du traitement sous la responsabilité et par un professionnel de santé expérimenté dans le traitement des hémopathies malignes et formé à l'administration et à la prise en charge de patients traités par YESCARTA. Au minimum 4 doses de tocilizumab à utiliser en cas de syndrome de relargage cytokinique (CRS) et un équipement d'urgence doivent être disponibles avant la perfusion de YESCARTA.
YESCARTA est destiné à un usage autologue uniquement.
Aux différentes étapes d'utilisation, il faut toujours vérifier la correspondance entre le produit et le patient : le numéro d'identification (ID) du patient doit toujours correspondre aux identifiants du patient qui figurent sur la poche de YESCARTA.
Préparation de YESCARTA : modifier génétiquement les cellules T du patient
Chaque préparation de YESCARTA est produite pour un patient à partir de ses propres cellules T (Cf. Encadré 1).
Ces cellules sont :
- prélevées par leucaphérèse,
- puis génétiquement modifiées par transduction rétrovirale pour exprimer le CAR ciblant la protéine CD19,
- les cellules viables positives pour le CAR T anti-CD19 sont amplifiées,
- avant d'être reperfusées au patient.
La préparation correspond à une dose unique de YESCARTA, contenant 2 x 106 cellules viables positives pour le CAR T par kg de poids corporel (ou au maximum 2 x 108 cellules viables positives pour le CAR T pour les patients d'un poids supérieur ou égal à 100 kg) dans une poche de perfusion contenant environ 68 mL de dispersion.
Dans les études (ZUMA-1), le délai médian pour la fabrication de YESCARTA (de la leucaphérèse à la réception sur le site de l'étude) a été de 17 jours, soit un délai médian de 23 jours entre la leucaphérèse et la perfusion.
La disponibilité de YESCARTA doit être confirmée avant de commencer la chimiothérapie lymphodéplétive.
Encadré 1 - Préparation de YESCARTA
(Cf. Monographie VIDAL de ZESCARTA - Rubrique Posologie et Mode d'administration)
|
Préparation du patient avant l'administration de YESCARTA
Une chimiothérapie lymphodéplétive doit être instaurée avant la perfusion de YESCARTA afin d'éliminer les globules blancs du patient :
- administration de cyclophosphamide 500 mg/m² par voie intraveineuse et de fludarabine 30 mg/m² par voie intraveineuse aux 5e, 4e et 3e jours avant la perfusion de YESCARTA.
- 500 à 1 000 mg de paracétamol par voie orale,
- et 12,5 à 25 mg de diphénhydramine par voie intraveineuse ou orale (ou équivalent) environ 1 heure avant la perfusion de YESCARTA.
L'utilisation de corticoïdes systémiques à titre préventif est déconseillée car elle pourrait altérer l'activité de YESCARTA.
Administration de YESCARTA : perfusion intraveineuse unique
YESCARTA doit être administré par perfusion intraveineuse unique (goutte à goutte).
Aucun filtre de réduction leucocytaire ne doit être utilisé.
Un accès veineux central est recommandé pour l'administration de YESCARTA.
Avant la perfusion, il est recommandé d'amorcer la tubulure avec une solution de chlorure de sodium à 0,9 % (0,154 mmol de sodium par mL).
La totalité du contenu de la poche de YESCARTA doit être perfusé en 30 minutes, par gravité ou au moyen d'une pompe péristaltique.
La poche doit être agitée délicatement pendant la perfusion de YESCARTA, pour éviter l'agrégation des cellules.
Une fois que la totalité du contenu de la poche a été perfusée, la tubulure doit être rincée avec une solution de chlorure de sodium à 0,9 % (0,154 mmol de sodium par mL) en gardant le même débit de perfusion afin de s'assurer que la totalité de YESCARTA a été administrée.
Modalités de conservation et stabilité de YESCARTA
YESCARTA est conservé congelé dans la phase vapeur de l'azote liquide (inférieur ou égal à -150 °C).
YESCARTA doit rester congelé jusqu'à ce que le patient soit prêt pour le traitement, afin de s'assurer que le patient reçoit bien des cellules autologues viables.
Après la décongélation, YESCARTA est stable à température ambiante (20 à 25 °C) jusqu'à 3 heures. La perfusion de YESCARTA doit commencer dans les 30 minutes suivant la fin de la décongélation et la durée totale de la perfusion de YESCARTA ne doit pas dépasser 30 minutes.
YESCARTA ne doit pas être irradié. Une irradiation peut entraîner l'inactivation du produit.
Surveillance des patients : une hospitalisation de 10 jours suivant la perfusion
Les patients doivent être suivis quotidiennement pendant les 10 premiers jours suivant la perfusion pour détecter d'éventuels signes et symptômes de CRS (syndrome de relargage des cytokines), d'effets neurologiques et d'autres toxicités.
Les médecins doivent envisager une hospitalisation pendant les 10 premiers jours suivant la perfusion ou en cas d'apparition des premiers signes ou symptômes d'un CRS et/ou d'effets neurologiques.
A l'issue des 10 premiers jours suivant la perfusion, le patient doit faire l'objet d'un suivi dont les modalités sont laissées à la discrétion du médecin.
Les patients auront pour consigne de rester à proximité d'un établissement de santé qualifié pendant au moins 4 semaines après la perfusion.
Identité administrative
- Liste I
- Réservé à l'usage hospitalier
- Prescription réservée aux spécialistes en hématologie ou aux médecins compétents en maladies du sang
- Surveillance particulière pendant le traitement
- Poche de 68 mL, CIP 3400955057413, UCD 3400894404569 (poche)
- Agrément aux collectivité (Journal officiel du 13 juillet 2019 - texte 5)
- Inscrit sur la liste des spécialités prises en charge en sus des GHS (Journal officiel du 13 juillet 2019 - texte 6)
- Prise en charge subordonnée au recueil et à la transmission de certaines informations relatives à sa prescription précisées au II de l'annexe de l'arrêté du 8 juillet 2019 (Journal officiel du 13 juillet 2019 - texte 7)
- Prix HT par UCD = 327 000 euros
- Laboratoire Gilead Sciences
Pour aller plus loin
Avis de la commission de la Transparence - YESCARTA (HAS, 5 décembre 2018 - mis en ligne le 22 février 2019)
CAR-T cells : des médicaments prometteurs, que la HAS réévaluera pour en confirmer le potentiel (communiqué HAS, 27 mai 2019)
Résumé EPAR pour le public - YESCARTA
L'étude pivot :
Neelapu SS et al. Axicabtagene Ciloleucel CAR T-cell therapy in refractory large b-cell lymphoma. N Engl J Med 2017 ; 377(26) : 2531-44
Pour aller plus loin
Consultez les monographies VIDAL
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 9 minutes
9 minutes Ajouter un commentaire
Ajouter un commentaire




Commentaires
Cliquez ici pour revenir à l'accueil.