
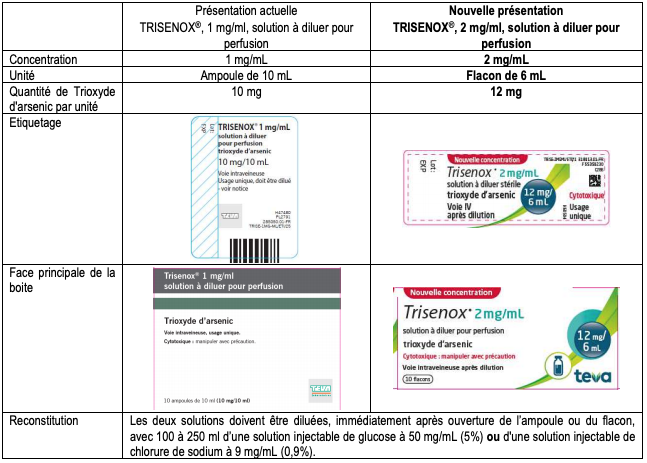
Différences entre le nouveau dosage de TRISENOX (à droite) et celui déjà commercialisé (à gauche).
Un nouveau dosage de TRISENOX solution à diluer pour perfusion est mis à disposition :
- TRISENOX 2 mg/mL solution à diluer pour perfusion, en flacon de 6 mL (12 mg de trioxyde d'arsenic par flacon).
Dans un premier temps, ces deux dosages de TRISENOX vont coexister sur le marché, mais à l'issue d'une période indéterminée à ce jour, TRISENOX 2 mg/mL remplacera TRISENOX 1 mg/mL.
Les indications thérapeutiques de TRISENOX 1 mg/mL et 2 mg/mL sont identiques (cf. Encadré 1).
Encadré 1 - Indication thérapeutique de TRISENOX 1 mg/mL et 2 mg/mL
TRISENOX est indiqué pour l'induction de la rémission et la consolidation chez des patients adultes atteints de :
|
Coexistence de 2 dosages de TRISENOX : attention aux confusions
Dans un point d'information en date du 31 mars 2020, l'ANSM (Agence nationale de sécurité du médicament et des produits de santé) informe les professionnels de santé de la coexistence temporaire sur le marché et dans les services hospitaliers des 2 concentrations de TRISENOX et les mets en garde sur le risque d'erreur médicamenteuse par confusion, avec pour conséquence :
- un risque de sous-dosage, rendant le traitement potentiellement inefficace et pouvant entraîner une résistance à la chimiothérapie anticancéreuse avec une réponse clinique réduite ;
- un risque de sur-dosage, potentiellement fatal pour le patient (cf. Encadré 2).
Encadré 2 - Événements potentiellement consécutifs à un surdosage en TRISENOX
|
L'ANSM indique, en outre, que ce risque d'erreur est majoré par l'arrivée récente sur le marché de plusieurs spécialités génériques concentrées à 1 mg/mL, sous forme d'ampoules ou de flacons (TRIOXYDE D'ARSENIC ARROW 1 mg/mL en ampoule commercialisé depuis le 6 janvier 2020, et TRIOXYDE D'ARSENIC ACCORD 1 mg/mL en flacon commercialisé depuis le 18 février 2020).
Dans ce contexte, et pour minimiser le risque d'erreur médicamenteuse, le laboratoire TEVA et l'ANSM précisent les différences entre l'ancien et le nouveau dosage de TRISENOX (cf. Tableau I).
Tableau I - Comparaison entre TRISENOX 1 mg/mL et TRISENOX 2 mg/mL (source : Lettre aux Professionnels de santé, mars 2020)
Les équipes soignantes doivent être vigilantes et prendre les dispositions nécessaires pour éviter toute confusion entre les concentrations de TRISENOX, en particulier lors du calcul de la dilution et du volume de perfusion de TRISENOX.
Outre la différence de conditionnement primaire (ampoule ou flacon), les boîtes de TRISENOX 1 mg/mL et TRISENOX 2 mg/mL sont différentes (cf. Tableau I ci-dessus).
Comme précisé dans la lettre aux professionnels de santé datée de mars 2020, la reconstitution nécessite pour les deux dosages de TRISENOX une dilution des solutions, immédiatement après ouverture de l'ampoule ou du flacon, avec 100 à 250 mL d'une solution injectable de glucose à 50 mg/mL (5 %) ou d'une solution injectable de chlorure de sodium à 9 mg/mL (0,9 %).
Pour aller plus loin
Nouvelles présentations de spécialités à base de trioxyde d'arsenic : attention au risque d'erreur médicamenteuse - Point d'information (ANSM, 31 mars 2020)
Communiqué : TRISENOX (trioxyde d'arsenic) - Risque d'erreur médicamenteuse en raison de la mise à disposition d'une nouvelle concentration de 2 mg / ml (ANSM, 31 mars 2020)
Lettre du laboratoire TEVA aux hématologues, oncologues, médecins compétents en cancérologie ou en maladies du sang, et pharmaciens hospitaliers (sur le site de l'ANSM, mars 2020)
Pour aller plus loin
Consultez les monographies VIDAL
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 4 minutes
4 minutes Ajouter un commentaire
Ajouter un commentaire






Commentaires
Cliquez ici pour revenir à l'accueil.