L’origine du dimorphisme sexuel remonte à la conception avec le développement d’un embryon porteur des chromosomes XX ou XY. Sur le plan physiopathologique, ce dimorphisme sexuel est associé à des différences de risques (auto-immunité plus fréquente chez la femme), de manifestations cliniques (COVID-19 plus sévère chez l’homme) et de réponse aux médicaments.
Différences pharmacocinétiques liées au sexe
La pharmacocinétique (PK) comprend l’absorption, la distribution, le métabolisme et l’excrétion (clairance). Il existe de nombreuses différences anatomiques, physiologiques et biologiques entre hommes et femmes pouvant impacter la PK (tableau 1).
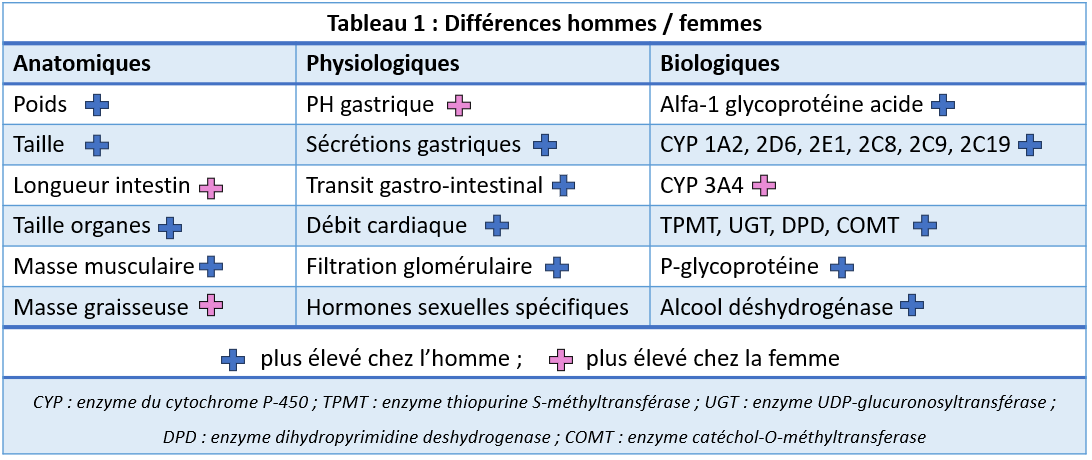
L’impact du sexe sur les divers paramètres PK est substance-spécifique, i.e. dépend des caractéristiques (physico-chimiques, voie d’élimination) de la substance, par ex. l’absorption du kétoprofène (AINS) est un peu plus lente chez la femme que chez l’homme, alors que l’inverse est vrai pour l’éthanol. L’absorption plus rapide de l’éthanol, à l’origine de concentrations pic plus élevées, est essentiellement due à une activité plus faible de l’alcool déshydrogénase gastrique chez la femme. Par rapport à l’homme, la composition corporelle de la femme est caractérisée par une masse grasse plus élevée et une masse hydrique plus basse. En s'accumulant dans la graisse corporelle, qui agit comme un réservoir, la demi-vie des médicaments lipophiles peut être prolongée chez la femme. La concentration pic des médicaments hydrophiles peut être plus élevée chez la femme, du fait que ces médicaments se distribuent dans un volume plus petit que chez l’homme. L’effet du sexe sur la distribution a toutefois globalement peu d’impact. L’obésité a un impact plus marqué que le sexe sur la distribution des médicaments lipophiles, tout comme le poids maigre sur la distribution des médicaments hydrophiles.
La clairance est le paramètre PK le plus impacté par le sexe. L’homme a une clairance des médicaments plus élevée que la femme, du fait d’organes d’élimination (foie, reins) plus grands, ainsi que d’une activité enzymatique plus importante indépendamment de la taille des organes. Les recommandations posologiques, jusqu’à récemment basées sur des études PK conduites quasi exclusivement chez des sujets masculins (craintes de tératogénicité), étant les mêmes pour les hommes et les femmes, ces dernières tendent à être systématiquement surexposées. Cette surexposition est modérée, avec des concentrations de l’ordre de +20% en moyenne par rapport à l’homme (1). Le zolpidem fait exception : des concentrations de + 40 à 50% chez la femme ont conduit à des recommandations posologiques différentes selon le sexe aux Etats-Unis en 2013 (2).
Différences pharmacodynamiques liées au sexe
La pharmacodynamique (PD) est la relation entre l’exposition aux médicaments et les effets recherchés ou indésirables. Dans une étude, l’efficacité maximale de la vasopressine a été observée à des concentrations plus basses chez la femme que chez l’homme et l’hyponatrémie était plus fréquente chez la femme (3). La suppression de sécrétion du cortisol est survenue à des concentrations plus basses de méthylprednisolone chez la femme que chez l’homme (4). Chez des volontaires sains, à concentrations équivalentes, la quinidine a entrainé un allongement du QT plus marqué chez la femme que chez l’homme (5). Les différences PD liées au sexe restent moins bien étudiées que les différences PK.
Synthèse
Le sexe n’est qu’un facteur de variabilité parmi d’autres et la variabilité PK au sein d’une population de même sexe est plus grande que la variabilité PK entre sexes. Les facteurs majeurs de variabilité PK interindividuelle sont les fonctions rénale et hépatique, à prendre systématiquement en compte lors de la prescription.
Les femmes tendent néanmoins à être surexposées aux médicaments par rapport aux hommes. Bien que cette surexposition soit modérée, son caractère systématique est problématique à l’échelle de la population, à l’origine d’une partie de l’excès d’effets indésirables chez les femmes (+60% comparé aux hommes) (6).
Dans certains contextes, les traitements prescrits aux femmes devraient être débutés avec le dosage recommandé le plus bas, à titrer ensuite selon la réponse/tolérance, pour autant que cela soit possible du point de vue clinique (par ex. HTA, hyperlipidémie, …). Cette recommandation n’est pas généralisable aux traitements de pathologies aiguës ou d’oncologie.
Article rédigé par :
Docteure Françoise LIVIO
Service de Pharmacologie Clinique
Centre Hospitalier Universitaire Vaudois
Lausanne, Suisse
(1) Stader F, et al. Sex-related pharmacokinetics differences with aging. Eur Geriatr Med 2022;13:559-565.
(2) Greenblatt DJ, et al. Gender differences in pharmacokinetics and pharmacodynamics of zolpidem following sublingual administration. J Clin Pharmacol 2014;54:282-290.
(3) Juul KV, et al. Gender difference in antidiuretic response to desmopressin. Am J Physiol Renal Physiol 2011;300:F1116-F1122.
(4) Lew KH, et al. Gender-based effects on methylprednisolone pharmacokinetics and pharmacodynamics. Clin Pharmacol Ther 1993;54:402-414.
(5) El-Eraky H, et al. Effects of sex on the pharmacokinetic and pharmacodynamic properties of quinidine. Br J Clin Pharmacol 2003;56:198-204.
(6) Martin RM, et al. Age and sex distribution of suspected adverse drug reactions to newly marketed drugs in general practice in England: analysis of 48 cohort studies. Br J Clin Pharmacol 1998;46:505-511.

 5 minutes
5 minutes
