Classification pharmacothérapeutique VIDAL
Neurologie > Antiépileptiques > Benzodiazépines (Midazolam)
Classification ATC
SYSTEME NERVEUX > PSYCHOLEPTIQUES > HYPNOTIQUES ET SEDATIFS > DERIVES DE LA BENZODIAZEPINE (MIDAZOLAM)
Excipients
sodium chlorure, eau ppi, acide chlorhydrique, sodium hydroxyde
Présentation
BUCCOLAM 5 mg S bucc 4Ser/1ml
Cip : 3400922108599
Modalités de conservation : Avant ouverture : durant 18 mois (Conserver dans son emballage, Ne pas congeler, Ne pas conserver au réfrigérateur)
| | par seringue |
Midazolam (DCI) chlorhydrate exprimé en midazolam
| 2,5 mg |
| ou | 5 mg |
| ou | 7,5 mg |
| ou | 10 mg |
Excipients (communs) :
chlorure de sodium, eau ppi, acide chlorhydrique (pour l'ajustement du pH et la transformation du midazolam en sel chlorhydrate), hydroxyde de sodium (pour l'ajustement du pH).
pH : 2,9 à 3,7.
Traitement des crises convulsives aiguës prolongées chez les nourrissons, jeunes enfants, enfants et adolescents (de 3 mois à moins de 18 ans).
Buccolam ne doit être utilisé par les parents/accompagnants que lorsqu'un diagnostic d'épilepsie a été fait.
Chez les nourrissons âgés de 3 à 6 mois, le traitement doit être administré en milieu hospitalier afin d'assurer une surveillance et de disposer d'un équipement de réanimation.
Cf Posologie et Mode d'administration.
POSOLOGIE ET MODE D'ADMINISTRATION |
Connectez-vous pour accéder à ce contenu
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
-
Insuffisance respiratoire :
- Le midazolam doit être utilisé avec prudence chez les patients présentant une insuffisance respiratoire chronique car il peut exacerber une dépression respiratoire.
-
Enfants âgés de 3 à 6 mois :
- Du fait du rapport métabolite/molécule mère élevé chez les jeunes enfants, le risque de dépression respiratoire différée due aux concentrations élevées du métabolite actif chez les enfants de 3 à 6 mois ne peut pas être exclu. Par conséquent, chez les enfants de 3 à 6 mois, Buccolam ne doit être administré que sous la surveillance d'un professionnel de santé lorsqu'un équipement de réanimation est disponible, que la fonction respiratoire peut être surveillée et qu'un équipement d'assistance respiratoire est disponible en cas de besoin.
-
Diminution de l'élimination du midazolam :
- Le midazolam doit être utilisé avec prudence chez les patients présentant une insuffisance rénale chronique, une insuffisance hépatique ou une insuffisance cardiaque. Le midazolam peut s'accumuler chez les patients présentant une insuffisance rénale chronique ou une insuffisance hépatique, tandis que sa clairance peut être diminuée chez les patients présentant une insuffisance cardiaque.
-
Utilisation concomitante avec d'autres benzodiazépines :
- Les patients en mauvais état général sont plus sensibles aux effets des benzodiazépines sur le système nerveux central (SNC) et des doses plus faibles peuvent donc s'avérer nécessaires.
-
Antécédents d'alcoolisme ou de toxicomanie :
- Le midazolam doit être évité chez les patients ayant des antécédents d'alcoolisme ou de toxicomanie.
-
Amnésie :
- Le midazolam peut provoquer une amnésie antérograde.
-
Excipients :
-
Sodium : ce médicament contient moins de 1 mmol (23 mg) de sodium par seringue orale, c.-à-d. qu'il est essentiellement « sans sodium ».
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Grossesse :
Il n'existe pas de données ou il existe des données limitées sur l'utilisation du midazolam chez la femme enceinte. Les études de toxicité sur la reproduction effectuées chez l'animal n'ont pas mis en évidence d'effet malformatif, mais une toxicité pour le fœtus a été observée chez l'homme, comme avec les autres benzodiazépines. Il n'existe pas de données sur l'utilisation du midazolam pendant les deux premiers trimestres de la grossesse.
L'administration de doses élevées de midazolam pendant le dernier trimestre de la grossesse ou pendant le travail peut entraîner des effets indésirables maternels ou fœtaux (risque d'aspiration des liquides et du contenu de l'estomac pendant le travail chez la mère, irrégularités de la fréquence cardiaque chez le fœtus, hypotonie, difficultés de succion, hypothermie et dépression respiratoire chez le nouveau-né).
Le midazolam peut être administré pendant la grossesse en cas de nécessité absolue. Le risque pour le nouveau-né doit être pris en compte en cas d'administration de midazolam pendant le troisième trimestre de la grossesse.
Allaitement :
Le midazolam est excrété en faibles quantités (0,6 %) dans le lait maternel humain. Par conséquent l'allaitement ne doit pas nécessairement être interrompu après une dose unique de midazolam.
Fertilité :
Les études effectuées chez l'animal n'ont pas mis en évidence une diminution de la fertilité (cf Sécurité préclinique).
CONDUITE et UTILISATION DE MACHINES |
Le midazolam a une influence importante sur l'aptitude à conduire des véhicules et à utiliser des machines.
La sédation, l'amnésie, la diminution de l'attention et l'altération de la fonction musculaire peuvent affecter l'aptitude à conduire, à rouler en bicyclette ou à utiliser des machines. Le patient doit être averti qu'il ne doit pas conduire ou utiliser une machine après l'administration de midazolam tant qu'il n'a pas complètement récupéré.
-
Symptômes :
- Un surdosage de midazolam peut engager le pronostic vital si le patient présente une insuffisance respiratoire ou cardiaque préexistante, ou si le médicament est associé à d'autres dépresseurs du SNC (y compris l'alcool).
- Un surdosage de benzodiazépines se manifeste généralement par différents degrés de dépression du système nerveux central allant de la somnolence au coma. Dans les cas bénins, les symptômes sont la somnolence, la confusion mentale et la léthargie ; dans les cas plus graves, les symptômes peuvent être l'ataxie, l'hypotonie, l'hypotension, la dépression respiratoire, rarement le coma et très rarement le décès.
-
Conduite à tenir :
- Pour le traitement d'un surdosage de tout médicament, il convient de tenir compte du fait que le patient peut avoir pris plusieurs produits.
- En cas de surdosage de midazolam oral, la conduite à tenir consiste à induire les vomissements (dans l'heure qui suit) si le patient est conscient ou à pratiquer un lavage gastrique en protégeant les voies respiratoires si le patient est inconscient. Si le lavage gastrique n'est pas efficace, du charbon activé doit être administré pour diminuer l'absorption. Les fonctions respiratoire et cardiovasculaire doivent être surveillées étroitement dans un service de soins intensifs.
- L'administration de flumazénil à titre d'antidote peut être utile.
Aucun effet indésirable sur la fertilité n'a été observé dans une étude de la fertilité chez le rat au cours de laquelle les animaux ont reçu jusqu'à dix fois la dose utilisée en clinique.
Il n'existe pas de données précliniques pertinentes pour le prescripteur autres que celles qui figurent déjà dans d'autres rubriques du RCP.
MODALITÉS DE CONSERVATION |
-
Durée de conservation :
-
Solution buccale à 2,5 mg : 18 mois.
-
Solution buccale à 5 mg, à 7,5 mg et à 10 mg : 2 ans.
Conserver la seringue pour administration orale dans le tube en plastique de protection.
Ne pas mettre au réfrigérateur. Ne pas congeler.
MODALITÉS MANIPULATION/ÉLIMINATION |
-
Administration de Buccolam :
- Buccolam ne doit pas être administré par voie intraveineuse.
-
| Étapes 1 et 2 : |
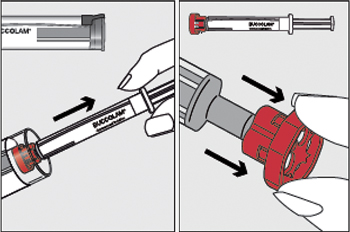 |
-
- Étape 1 :
Tout en tenant le tube en plastique, retirer le capuchon. Sortir la seringue du tube.
- Étape 2 :
Retirer le capuchon rouge de l'embout de la seringue et l'éliminer en toute sécurité.
-
| Étapes 3 et 4 : |
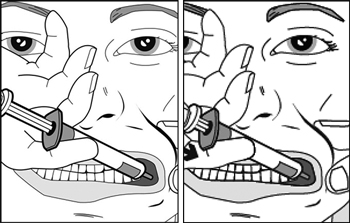 |
-
- Étape 3 :
Pincer délicatement la joue de l'enfant entre le pouce et l'index et tirer doucement vers l'arrière. Insérer l'embout de la seringue à l'arrière de l'espace entre la joue et la gencive inférieure.
- Étape 4 :
Appuyer lentement sur le piston de la seringue jusqu'à ce qu'il s'arrête.
La dose complète de solution doit être administrée lentement dans l'espace entre la gencive et la joue (cavité buccale).
Si nécessaire (pour des volumes plus importants et/ou des patients plus petits), la moitié de la dose environ doit être administrée lentement d'un côté de la bouche, puis l'autre moitié de l'autre côté.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
LISTE I
| Prescription sur ordonnance sécurisée. |
| Médicament soumis à prescription initiale annuelle réservée aux spécialistes en neurologie ou en pédiatrie. Renouvellement non restreint. |
| Médicament pouvant être administré par tout médecin intervenant en situation d'urgence ou dans le cadre d'une structure d'assistance médicale mobile ou de rapatriement sanitaire (article R. 5121-96 du code de la Santé publique). |
| AMM | EU/1/11/709/001 ; CIP 3400922108421 (RCP rév 22.05.2024) 2,5 mg. |
| EU/1/11/709/002 ; CIP3400922108599 (RCP rév 22.05.2024) 5 mg. |
| EU/1/11/709/003 ; CIP3400922108650 (RCP rév 22.05.2024) 7,5 mg. |
| EU/1/11/709/004 ; CIP3400922108711 (RCP rév 22.05.2024) 10 mg. |
| | |
| Prix : | 79,24 euros (4 ser à 2,5 mg, 5 mg, 7,5 mg ou 10 mg). |
|
Remb Sec soc à 65 % chez les nourrissons, jeunes enfants, enfants et adolescents (de 6 mois à moins de 18 ans).
Chez le nourrisson de 3 à 6 mois : le traitement doit être administré en milieu hospitalier.
Collect.
|
Titulaire de l'AMM : Neuraxpharm Pharmaceuticals, S.L., Avda. Barcelona 69, 08970 Sant Joan Despí, Barcelone, Espagne.

