Veuillez saisir au moins 3 caractères pour votre recherche.
- Médicaments
- BUVIDAL
- BUVIDAL 16 mg sol inj LP
Mise à jour : 22 août 2024
Sommaire
Connectez-vous pour accéder à ce contenu
SYNTHÈSE |
EEN sans dose seuil : soja lécithine, éthanol anhydre, caoutchouc
Cip : 3400930192689
Modalités de conservation : Avant ouverture : durant 36 mois (Ne pas congeler, Ne pas conserver au réfrigérateur)
FORMES et PRÉSENTATIONS |
Solution injectable à libération prolongée à 8 mg, 16 mg, 24 mg et 32 mg (liquide limpide, jaunâtre à jaune clair).
Administration hebdomadaire
Seringue préremplie de 1 ml avec un bouchon de piston, une aiguille (½ pouce, 23 G, 12 mm), un protège-aiguille, un dispositif de sécurité et une tige de piston, boîtes unitaires.
La seringue préremplie est assemblée dans un dispositif de sécurité en prévention des piqûres d'aiguille post-injection.
Le protège-aiguille de la seringue sécurisée peut contenir du latex qui peut provoquer des réactions allergiques chez les personnes sensibles au latex.
COMPOSITION |
Buvidal 8 mg en solution injectable à libération prolongée
Administration hebdomadaire
Chaque seringue préremplie contient 8 mg de buprénorphine
Buvidal 16 mg en solution injectable à libération prolongée
Administration hebdomadaire
Chaque seringue préremplie contient 16 mg de buprénorphine
Buvidal 24 mg en solution injectable à libération prolongée
Administration hebdomadaire
Chaque seringue préremplie contient 24 mg de buprénorphine
Buvidal 32 mg en solution injectable à libération prolongée
Administration hebdomadaire
Chaque seringue préremplie contient 32 mg de buprénorphine
Excipient à effet notoire
Les dosages à 8 mg, 16 mg, 24 mg et 32 mg contiennent 95,7 mg d'alcool (ethanol) par mL (10 % w/w).
Phosphatidylcholine de soja
Dioléate de glycérol
Éthanol anhydre
INDICATIONS |
Traitement de la dépendance aux opioïdes, dans le cadre d'une prise en charge médicale, sociale et psychologique. Le traitement est réservé aux adultes et aux adolescents âgés de 16 ans ou plus.
POSOLOGIE ET MODE D'ADMINISTRATION |
Connectez-vous pour accéder à ce contenu
CONTRE-INDICATIONS |
Connectez-vous pour accéder à ce contenu
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
Administration
Des précautions doivent être prises pour éviter toute injection accidentelle de Buvidal. La dose ne doit pas être administrée par voie intravasculaire (intraveineuse), intramusculaire ou intradermique (dans la peau).
Une injection par voie intravasculaire, par exemple intraveineuse, présente un risque grave du fait qu'au contact avec les fluides corporels Buvidal forme localement une masse solide qui potentiellement pourrait entrainer au niveau des vaisseaux sanguins une lésion ou une occlusion ou des événements thromboemboliques.
Afin de réduire le risque de mésusage, d'abus ou de détournement, les précautions adéquates doivent être prises lors de la prescription et de la délivrance de buprénorphine. Les professionnels de santé doivent administrer Buvidal directement au patient. L'utilisation à domicile ou l'auto-administration du produit par les patients n'est pas autorisée. Il convient de s'assurer pendant toute la durée du traitement que le patient n'essaie pas d'extraire le dépôt.
Propriétés à libération prolongée
Les propriétés de libération prolongée du produit doivent être prises en compte pendant le traitement, y compris à l'instauration et lors de l'arrêt du traitement (voir rubrique Posologie et mode d'administration). En particulier, les patients recevant des médicaments concomitants et/ou qui présentent des comorbidités doivent faire l'objet d'une surveillance des signes et symptômes de toxicité, de surdosage ou de sevrage causés par une augmentation ou une diminution des concentrations en buprénorphine (voir rubriques Interactions et Pharmacocinétique).
Dépression respiratoire
Des cas de décès dus à une dépression respiratoire ont été rapportés chez des patients traités par la buprénorphine, en particulier lorsque la buprénorphine a été utilisée en association avec des benzodiazépines (voir rubrique Interactions) ou lorsqu'elle n'avait pas été utilisée conformément à la prescription. Des décès ont également été rapportés après la prise concomitante de buprénorphine et d'autres dépresseurs du système nerveux central, tels que l'alcool, les gabapentinoïdes (prégabaline et gabapentine) (voir rubrique Interactions) ou d'autres opioïdes.
La buprénorphine doit être utilisée avec précaution chez les patients atteints d'insuffisance respiratoire (telle qu'une maladie pulmonaire obstructive chronique, asthme, cœur pulmonaire, diminution de la capacité respiratoire, hypoxie, hypercapnie, dépression respiratoire préexistante ou cyphoscoliose.
La buprénorphine peut provoquer une dépression respiratoire grave, potentiellement mortelle, chez les enfants et les personnes non dépendantes aux opioïdes en cas d'ingestion accidentelle ou volontaire.
Dépression du SNC
La buprénorphine peut provoquer une somnolence, particulièrement lorsqu'elle est prise avec de l'alcool ou des dépresseurs du système nerveux central tels que les benzodiazépines (tranquillisants, sédatifs, gabapentinoïdes ou hypnotiques) (voir rubriques Interactions et Conduite et utilisation de machines).
Dépendance
La buprénorphine est un agoniste partiel du récepteur opioïde mu, et son administration chronique peut entrainer une dépendance aux opioïdes.
Syndrome sérotoninergique
L'administration concomitante de Buvidal et d'autres agents sérotoninergiques, tels que les inhibiteurs de la MAO, les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS), les inhibiteurs de la recapture de la sérotonine et de la noradrénaline (IRSN) ou les antidépresseurs tricycliques, peut engendrer un syndrome sérotoninergique, qui est un syndrome potentiellement mortel (voir rubrique Interactions). Si un traitement concomitant avec d'autres agents sérotoninergiques est justifié sur le plan clinique, il est conseillé d'observer attentivement le patient, tout particulièrement pendant l'instauration du traitement et les augmentations de dose.
Les symptômes du syndrome sérotoninergique peuvent comprendre des modifications de l'état mental, une instabilité autonome, des anomalies neuromusculaires et/ou des symptômes gastro-intestinaux. En cas de suspicion de syndrome sérotoninergique, une réduction de dose ou un arrêt du traitement devra être envisagé(e) en fonction de la gravité des symptômes.
Hépatite et atteintes hépatiques
Un bilan hépatique et la recherche d'hépatite virale sont recommandés avant l'instauration du traitement. Les patients atteints d'hépatite virale, sous traitement médical concomitant (voir rubrique Interactions) et/ou qui présentent une altération de la fonction hépatique ont un risque accru d'atteinte du foie. Une surveillance régulière de la fonction hépatique est recommandée.
Des cas d'atteinte hépatique aiguë ont été signalés chez des patients dépendants aux opioïdes prenant des médicaments contenant de la buprénorphine, tant dans les essais cliniques que dans des rapports d'effets indésirables de pharmacovigilance. Les anomalies observées vont d'une élévation transitoire asymptomatique des transaminases hépatiques à des cas d'hépatite cytolytique, d'insuffisance hépatique, de nécrose hépatique, de syndrome hépatorénal, d'encéphalopathie hépatique et de décès. Dans de nombreux cas, la présence préexistante d'anomalies enzymatiques hépatiques, de maladie génétique, d'infection par le virus de l'hépatite B ou de l'hépatite C, d'abus d'alcool, d'anorexie, d'utilisation concomitante d'autres médicaments potentiellement hépatotoxiques et la persistance d'injection de drogues pourraient être responsables d'atteinte hépatique ou y contribuer. Ces facteurs sous-jacents doivent être pris en compte avant la prescription de buprénorphine et pendant le traitement. En cas de suspicion d'atteinte hépatique, un bilan biologique et étiologique est nécessaire. En fonction des résultats, il peut être nécessaire d'arrêter le traitement par Buvidal. La surveillance au-delà de la période de traitement hebdomadaire ou mensuel peut être nécessaire. Si le traitement est poursuivi, la fonction hépatique doit être étroitement surveillée.
Précipitation du syndrome de sevrage aux opioïdes
Lors de l'instauration d'un traitement par buprénorphine, il est important de prendre en compte le profil agoniste partiel de la buprénorphine. Les produits contenant de la buprénorphine peuvent précipiter l'apparition des symptômes de sevrage chez les patients dépendants aux opioïdes lorsqu'ils sont administrés avant la disparition des effets agonistes dus à un récent usage ou mésusage d'opioïdes. Afin d'éviter la précipitation des symptômes de sevrage, le traitement doit être instauré lorsque des signes et symptômes objectifs de sevrage léger à modéré sont évidents (voir rubrique Posologie et mode d'administration). L'arrêt du traitement peut entraîner un syndrome de sevrage d'apparition tardive.
Insuffisance hépatique
La buprénorphine est largement métabolisée par le foie. Les patients présentant une insuffisance hépatique modérée doivent faire l'objet d'une surveillance pour détecter des signes et symptômes de sevrage d'opioïdes, de toxicité ou de surdosage dus à une augmentation des taux de buprénorphine. La buprénorphine doit être utilisée avec précaution chez les patients atteints d'insuffisance hépatique modérée (voir rubriques Posologie et mode d'administration et Pharmacocinétique). La fonction hépatique doit être contrôlée régulièrement au cours du traitement. L'utilisation de buprénorphine est contre-indiquée chez les patients atteints d'insuffisance hépatique sévère (voir rubrique Contre-indications).
Insuffisance rénale
Les métabolites de la buprénorphine s'accumulent chez les patients atteints d'insuffisance rénale. La prudence est recommandée chez les patients atteints d'insuffisance rénale sévère (clairance de la créatinine < 30 ml/min) (voir rubriques Posologie et mode d'administration et Pharmacocinétique).
Allongement de l'intervalle QT
La prudence est recommandée en cas d'administration conjointe de Buvidal et d'autres médicaments qui allongent l'intervalle QT, ainsi que chez les patients ayant des antécédents de syndrome du QT long ou d'autres facteurs de risque d'allongement du QT.
Prise en charge de la douleur aiguë
Pour la prise en charge de la douleur aiguë pendant l'utilisation continue de Buvidal, l'utilisation d'antalgiques opioïdes forts avec une haute affinité au récepteur opioïde mu (par ex. fentanyl), d'antalgiques non opioïdes et d'anesthésie loco-régionale peut être nécessaire. Une augmentation posologique des antalgiques opioïdes de durée d'action courte (morphine à libération immédiate, oxycodone ou fentanyl), par voie orale ou intraveineuse, jusqu'à l'obtention de l'effet antalgique souhaité chez les patients traités par Buvidal, peut être nécessaire. Les patients doivent faire l'objet d'une surveillance pendant le traitement.
Utilisation chez les enfants et les adolescents
La sécurité et l'efficacité de la buprénorphine chez les enfants âgés de moins de 16 ans n'ont pas été établies (voir rubrique Posologie et mode d'administration). En raison du manque de données chez les adolescents (âgés de 16 ou 17 ans), les patients de cette tranche d'âge doivent être étroitement surveillés durant le traitement.
Troubles respiratoires liés au sommeil
Les opioïdes peuvent provoquer des troubles respiratoires liés au sommeil, notamment l'apnée centrale du sommeil (ASC) et l'hypoxémie liée au sommeil. Le risque d'ACS augmente en fonction de la dose d'opioïdes utilisée. Chez les patients présentant une ACS, une diminution de la dose totale d'opioïdes doit être envisagée.
Effets de classe
Les opioïdes peuvent provoquer une hypotension orthostatique.
Les opioïdes peuvent augmenter la pression du liquide céphalorachidien, ce qui peut être à l'origine de crises d'épilepsie. Par conséquent, ils doivent être utilisés avec précaution chez les patients atteints de traumatisme crânien, de lésions intracrâniennes, dans d'autres circonstances où la pression du liquide céphalorachidien peut être augmentée, ou en cas d'antécédents de crise d'épilepsie.
Les opioïdes doivent être utilisés avec précaution chez les patients atteints d'hypotension, d'hypertrophie prostatique ou de sténose urétrale.
Un myosis induit par les opioïdes, des altérations du niveau de conscience ou de la perception de la douleur en tant que symptôme d'une maladie peuvent interférer avec l'évaluation des patients ou compliquer le diagnostic ou l'évolution clinique d'une maladie concomitante.
Les opioïdes doivent être utilisés avec précaution chez les patients atteints de myxœdème, d'hypothyroïdie ou d'insuffisance corticosurrénale (par exemple, la maladie d'Addison).
Les opioïdes peuvent être responsables d'une augmentation de la pression du canal cholédoque, et doivent être utilisés avec précaution chez les patients présentant un dysfonctionnement des voies biliaires.
Latex
Aucun caoutchouc naturel ou latex n'est utilisé dans la formulation du protège aiguille. Néanmoins, la présence de traces négligeables ne peut être exclue et il existe donc un risque potentiel de réactions allergiques chez les personnes sensibles au latex qui ne peut être totalement exclu.
INTERACTIONS |
Connectez-vous pour accéder à ce contenu
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Grossesse
Il n'existe pas de données ou il existe des données limitées sur l'utilisation de la buprénorphine chez la femme enceinte. Les études effectuées chez l'animal n'ont pas mis en évidence de toxicité sur la reproduction (voir rubrique Sécurité préclinique). La buprénorphine ne doit être utilisée pendant la grossesse que si le bénéfice potentiel est supérieur au risque potentiel pour le fœtus.
En fin de grossesse, la buprénorphine peut provoquer une dépression respiratoire chez le nouveau-né même après une courte période d'administration. L'administration à long terme au cours des trois derniers mois de la grossesse peut provoquer un syndrome de sevrage chez le nouveau-né (par exemple hypertonie, tremblements du nouveau-né, agitation néonatale, myoclonie ou convulsions). Le syndrome est généralement retardé de plusieurs heures à plusieurs jours après la naissance.
En raison de la longue demi-vie de la buprénorphine, une surveillance néonatale pendant plusieurs jours après la naissance doit être envisagée pour prévenir le risque de dépression respiratoire ou le syndrome de sevrage chez le nouveau-né.
Allaitement
La buprénorphine et ses métabolites sont excrétés dans le lait maternel. Buvidal doit être utilisé avec précaution pendant l'allaitement.
Fertilité
Il n'existe pas de données ou il existe des données limitées sur les effets de la buprénorphine sur la fertilité humaine.
Les études effectuées chez l'animal n'ont pas mis en évidence d'effets délétères de la buprénorphine sur la fertilité (voir rubrique Sécurité préclinique).
CONDUITE et UTILISATION DE MACHINES |
La buprénorphine a une influence mineure à modérée sur l'aptitude à conduire des véhicules et à utiliser des machines lorsqu'elle est administrée à des patients dépendants aux opioïdes. La buprénorphine peut provoquer une somnolence, des vertiges ou une confusion mentale, en particulier pendant l'induction du traitement et l'adaptation posologique. En cas d'utilisation concomitante avec de l'alcool ou des dépresseurs du système nerveux central, l'effet risque d'être majoré (voir rubriques Mises en garde et précautions d'emploi et Interactions).
Il faut recommander au patient de ne pas conduire et de ne pas utiliser de machine dangereuse pendant qu'il prend ce médicament tant que l'effet du médicament sur le patient n'est pas connu. Une recommandation individuelle doit être faite par le professionnel de santé en charge du traitement.
EFFETS INDÉSIRABLES |
Connectez-vous pour accéder à ce contenu
SURDOSAGE |
Symptômes
Le principal symptôme nécessitant une intervention médicale en cas de surdosage par la buprénorphine est la dépression respiratoire consécutive à une dépression du système nerveux central, car elle peut conduire à un arrêt respiratoire et au décès. Les autres signes précoces de surdosage peuvent être une transpiration excessive, une somnolence, une amblyopie, un myosis, une hypotension, des nausées, des vomissements et/ou des troubles de l'élocution.
Prise en charge
Une prise en charge globale, comprenant notamment une surveillance étroite de la fonction respiratoire et cardiaque du patient, doit être instaurée. Un traitement symptomatique de la dépression respiratoire après les mesures habituelles de soins intensifs doit être mis en place. Une ventilation assistée ou contrôlée doit être assurée. Le patient doit être transféré dans une unité disposant de tous les moyens de réanimation nécessaires. Si le patient vomit, des précautions doivent être prises pour éviter qu'il inhale son vomi. L'utilisation d'un antagoniste opioïde (c.-à-d., la naloxone) est recommandée, malgré l'effet modeste qu'elle peut avoir dans la suppression des symptômes respiratoires induits par la buprénorphine comparé à ses effets sur les opioïdes agonistes complets.
La longue durée d'action de la buprénorphine et la libération prolongée de Buvidal doivent être prises en considération lors de la détermination de la durée du traitement nécessaire pour neutraliser les effets du surdosage (voir rubrique Mises en garde et précautions d'emploi). La naloxone peut être éliminée plus rapidement que la buprénorphine, de ce fait les symptômes du surdosage de la buprénorphine préalablement contrôlés par la naloxone peuvent réapparaître.
PHARMACODYNAMIE |
Connectez-vous pour accéder à ce contenu
PHARMACOCINÉTIQUE |
Connectez-vous pour accéder à ce contenu
SÉCURITÉ PRÉCLINIQUE |
La toxicité aiguë de la buprénorphine a été déterminée chez la souris et le rat après une administration orale et parentérale (intraveineuse, intrapéritonéale). Les effets indésirables étaient basés sur l'activité pharmacologique connue de la buprénorphine.
La buprénorphine a montré une faible toxicité tissulaire et biologique chez des chiens qui ont reçu le produit par voie sous-cutanée pendant un mois, chez des macaques rhésus qui l'ont reçu par voie orale pendant un mois et chez des rats et des babouins qui l'ont reçu par voie intramusculaire pendant six mois.
Des études de tératologie et de toxicité sur la reproduction menées chez le rat et le lapin en administration intramusculaire ont conclu que la buprénorphine n'est pas embryotoxique et n'a pas d'effet sensible sur le potentiel de sevrage de la progéniture. Chez le rat, aucun effet indésirable n'a été observé sur la fertilité de la fonction reproductrice générale.
Des études de toxicité chronique chez le rat et le chien des excipients utilisés pour Buvidal n'ont révélé aucun risque particulier pour l'homme.
INCOMPATIBILITÉS |
Ce médicament ne doit pas être mélangé avec d'autres médicaments.
DURÉE DE CONSERVATION |
3 ans
PRÉCAUTIONS PARTICULIÈRES DE CONSERVATION |
Ne pas mettre au réfrigérateur. Ne pas congeler
PRÉCAUTIONS PARTICULIÈRES D'ÉLIMINATION ET DE MANIPULATION |
Informations importantes
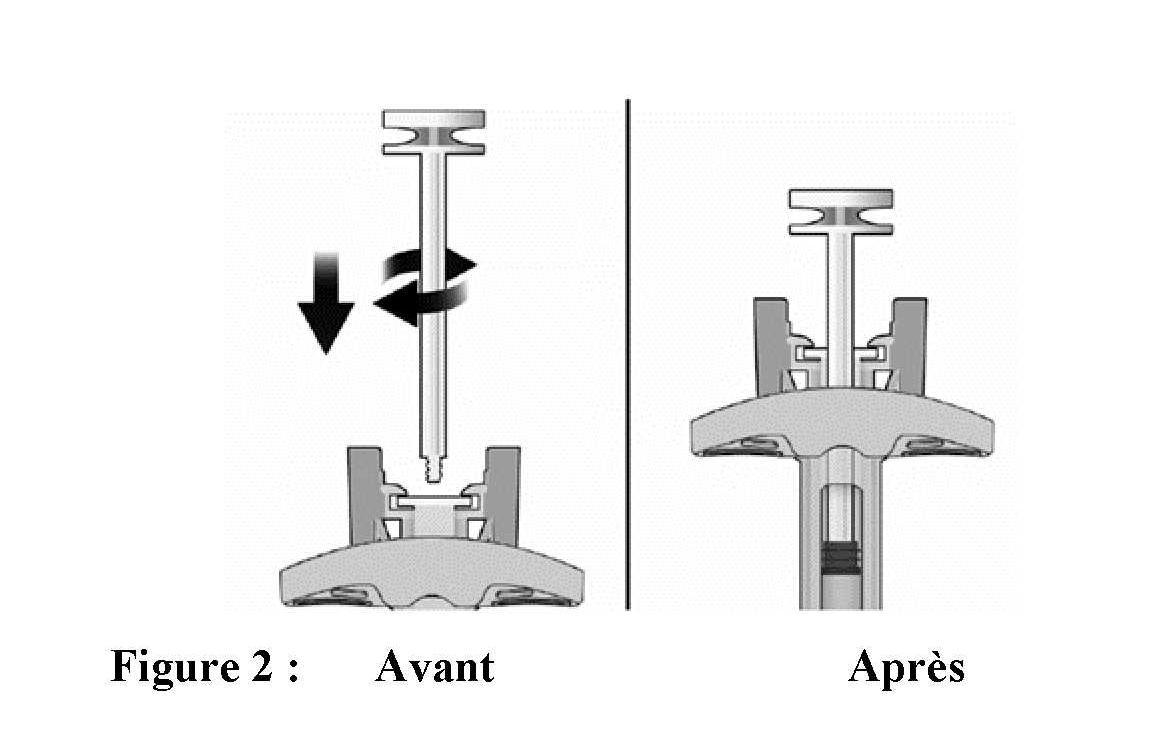
Avant l'administration
Éléments de la seringue sécurisée :

Veuillez noter que le plus petit volume d'injection est à peine visible dans la fenêtre de visualisation, car le ressort du dispositif de sécurité masque une partie du cylindre en verre près de l'aiguille.
Administration (voir aussi rubrique Posologie et mode d'administration)
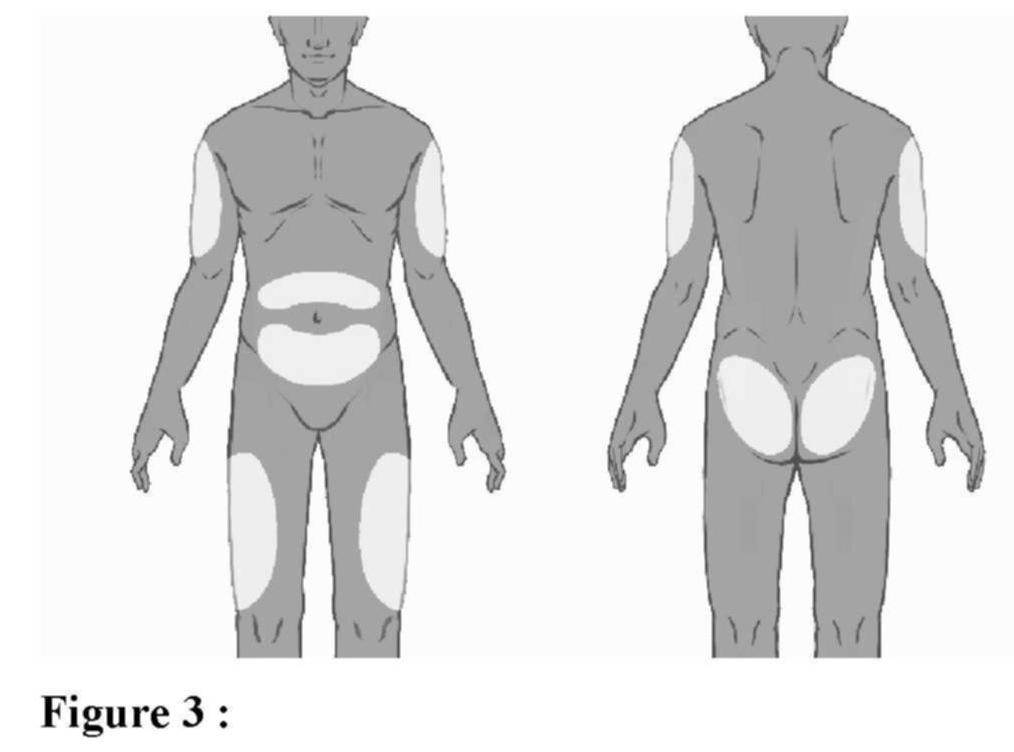
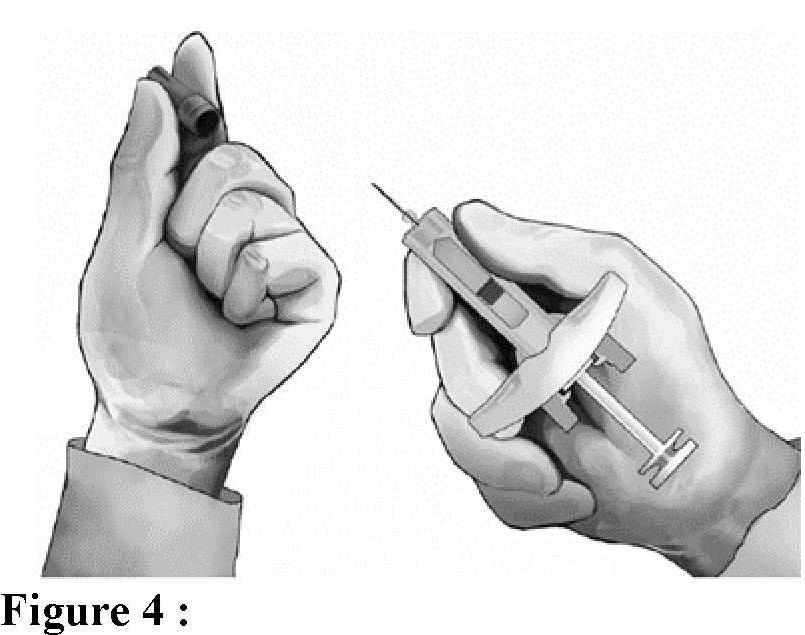
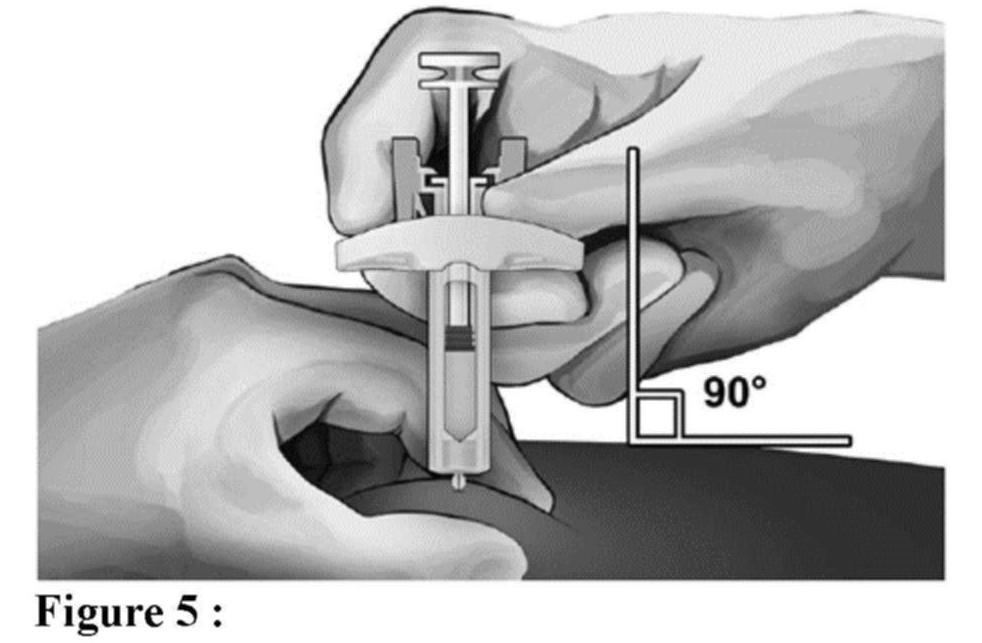
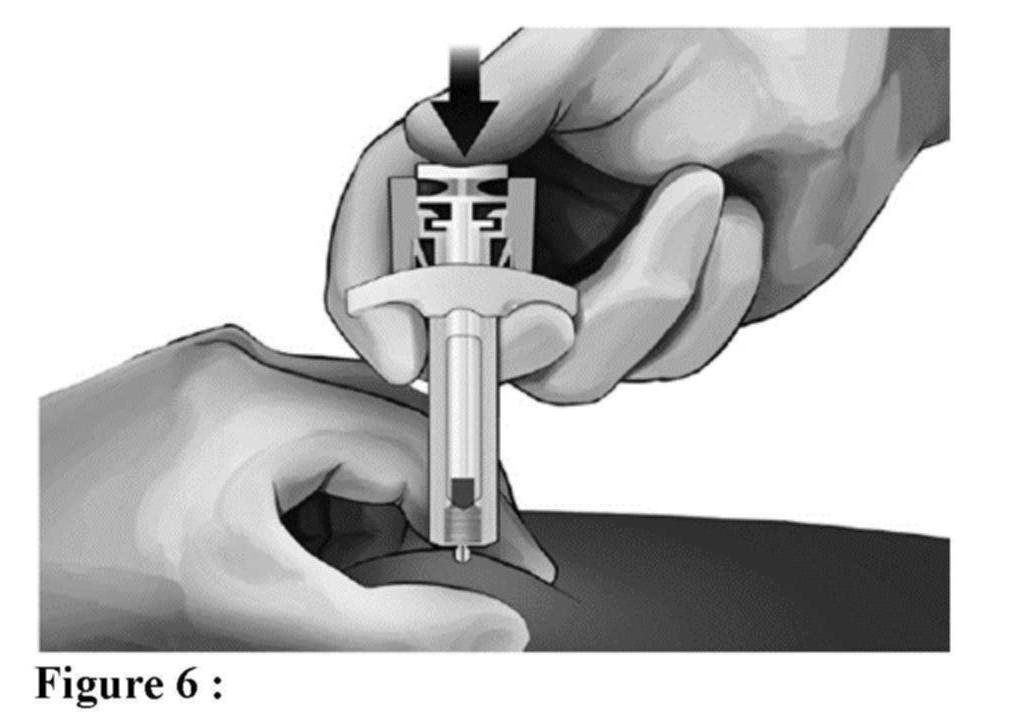
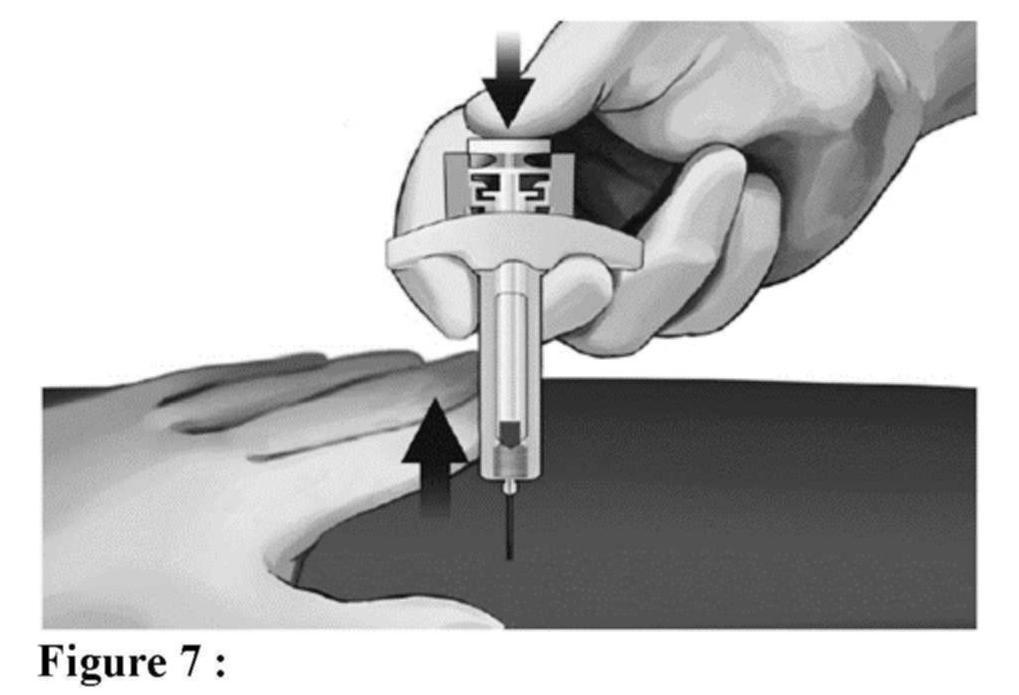
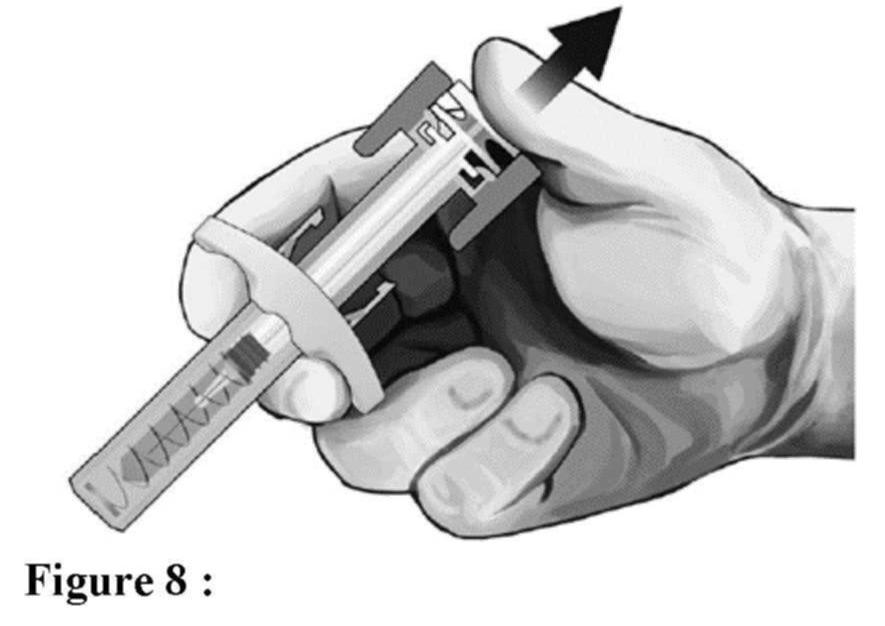
Élimination de la seringue
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
Administration hebdomadaire.
Liste I
Prescription sur ordonnance sécurisée. Prescription limitée à 28 jours.
Médicament réservé à l’usage professionnel selon l’article R.5121-80 du code de la santé publique.
Médicament soumis à prescription hospitalière et à prescription réservée aux médecins exerçant en centres de soins d’accompagnement et de prévention en addictologie (CSAPA).
Administration hospitalière ou en CSAPA.
Médicament nécessitant une surveillance particulière pendant le traitement.
| AMM |
|
Administration hebdomadaire.
Liste I
Prescription sur ordonnance sécurisée. Prescription limitée à 28 jours.
Médicament réservé à l’usage professionnel selon l’article R.5121-80 du code de la santé publique.
Médicament soumis à prescription hospitalière et à prescription réservée aux médecins exerçant en centres de soins d’accompagnement et de prévention en addictologie (CSAPA).
Administration hospitalière ou en CSAPA.
Médicament nécessitant une surveillance particulière pendant le traitement.
| AMM |
|
Administration hebdomadaire.
Liste I
Prescription sur ordonnance sécurisée. Prescription limitée à 28 jours.
Médicament réservé à l’usage professionnel selon l’article R.5121-80 du code de la santé publique.
Médicament soumis à prescription hospitalière et à prescription réservée aux médecins exerçant en centres de soins d’accompagnement et de prévention en addictologie (CSAPA).
Administration hospitalière ou en CSAPA.
Médicament nécessitant une surveillance particulière pendant le traitement.
| AMM |
|
Administration hebdomadaire.
Liste I
Prescription sur ordonnance sécurisée. Prescription limitée à 28 jours.
Médicament réservé à l’usage professionnel selon l’article R.5121-80 du code de la santé publique.
Médicament soumis à prescription hospitalière et à prescription réservée aux médecins exerçant en centres de soins d’accompagnement et de prévention en addictologie (CSAPA).
Administration hospitalière ou en CSAPA.
Médicament nécessitant une surveillance particulière pendant le traitement.
| AMM |
|
