Veuillez saisir au moins 3 caractères pour votre recherche.
- Médicaments
- COSTEC
- COSTEC 20 mg/ml + 5 mg/ml collyre sol
Mise à jour : 22 août 2024
Sommaire
SYNTHÈSE |
résidu du contenant : argent
Cip : 3400930158494
Modalités de conservation : Avant ouverture : < 25° durant 24 mois
Après ouverture : durant 2 mois
FORMES et PRÉSENTATIONS |
Collyre en solution.
Solution claire, incolore ou presque, légèrement visqueuse, pratiquement exempte de particules visibles, avec un pH entre 5,5 et 5,9 et une osmolalité de 240-325 mOsmol/kg.
Flacon de 10 ml de solution, avec embout compte-gouttes, boîte unitaire.
COMPOSITION |
Pour 1 ml :
Dorzolamide : 20 mg
Sous forme de chlorhydrate de dorzolamide : 22,26 mg
Timolol : 5 mg
Sous forme de maléate de timolol : 6,83 mg
Une goutte (environ 0,03 ml) contient en moyenne 0,6 mg de dorzolamide et 0,15 mg de timolol.
Hydroxyéthylcellulose, mannitol, citrate de sodium, hydroxyde de sodium pour l'ajustement du pH, eau pour préparations injectables.
INDICATIONS |
COSTEC est indiqué dans le traitement de la pression intra-oculaire élevée (PIO) chez les patients présentant un glaucome à angle ouvert ou un glaucome pseudo-exfoliatif, lorsqu'une monothérapie par bêta-bloquant administrée par voie oculaire est insuffisante.
POSOLOGIE ET MODE D'ADMINISTRATION |
Connectez-vous pour accéder à ce contenu
CONTRE-INDICATIONS |
Connectez-vous pour accéder à ce contenu
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
Réactions cardio-vasculaires/respiratoires
Comme pour d'autres médicaments à usage ophtalmique administrés par voie locale, le timolol passe dans la circulation générale. A cause du composé bêta-adrénergique, le timolol, les mêmes types d'effets cardiovasculaires, pulmonaires et autres effets secondaires que ceux observés avec les bêta-bloquants pris par voie générale peuvent survenir. L'incidence des effets indésirables systémiques après instillation ophtalmique est inférieure à celle survenant après l'administration par voie générale. Pour la réduction de l'absorption systémique : voir rubrique Posologie et mode d'administration.
Affections cardiaques
Les patients ayant des maladies cardiovasculaires (par exemple, coronaropathie, angor de Prinzmetal et insuffisance cardiaque) et sous traitement hypotenseur par bêta-bloquant doivent être évalués de manière critique et un traitement utilisant d'autres substances actives doit être envisagé. Chez les patients ayant des maladies cardiovasculaires, les signes de détérioration de leur maladie ou la survenue d'effets secondaires doivent être surveillés.
Du fait de leur effet négatif sur le temps de conduction, les bêta-bloquants ne doivent être administrés qu'avec prudence chez les patients ayant un bloc cardiaque du premier degré.
Affections vasculaires
Les patients ayant des troubles/désordres circulatoires sévères périphériques (par exemple formes sévères de la maladie ou du syndrome de Raynaud) doivent être traités avec prudence.
Affections respiratoires
Des réactions respiratoires, y compris le décès par bronchospasme chez des patients asthmatiques ont été rapportées après administration de bêta-bloquants ophtalmiques.
COSTEC doit être utilisé avec prudence chez les patients ayant une broncho-pneumopathie chronique obstructive (BPCO) légère à modérée, et seulement si le bénéfice potentiel est supérieur au risque potentiel.
Insuffisance hépatique
Ce médicament n'a pas été étudié chez les patients présentant une insuffisance hépatique et doit donc être utilisé avec précaution chez de tels patients.
Immunologie et hypersensibilité
Comme pour tous les autres médicaments à usage ophtalmique administrés par voie locale, le dorzolamide peut passer dans la circulation générale. Le dorzolamide contient un groupe sulfonamide qui existe également chez les sulfamides. Par conséquent, les mêmes types d'effets secondaires que ceux observés avec les sulfamides par voie générale peuvent survenir par voie locale, incluant des réactions sévères telles que syndrome de Stevens-Johnson et nécrolyse épidermique toxique. En cas de réactions graves ou d'hypersensibilité, ce médicament doit être arrêté.
Des effets secondaires oculaires, identiques à ceux observés avec les collyres à base de chlorhydrate de dorzolamide ont été observés avec ce médicament. Si de telles réactions surviennent, l'arrêt de COSTEC doit être envisagé.
Les patients prenant des bêta-bloquants et ayant des antécédents d'atopie ou des antécédents de réactions anaphylactiques sévères à divers allergènes peuvent avoir des réactions plus intenses lors d'une provocation allergénique par contacts répétés avec ces allergènes et peuvent ne pas répondre aux doses habituelles d'adrénaline utilisées pour traiter de telles réactions anaphylactiques.
Traitement concomitant
L'effet sur la pression intra-oculaire ou les effets connus des bêta-bloquants systémiques peuvent être potentialisés lorsque le timolol est administré à des patients déjà traités par un bêta-bloquant systémique. La réponse de ces patients devra être étroitement surveillée. L'utilisation de 2 agents bêta-bloquants administrés par voie locale n'est pas recommandée (voir rubrique Interactions).
L'utilisation du dorzolamide et des inhibiteurs de l'anhydrase carbonique oraux n'est pas recommandée.
Arrêt du traitement
Comme avec les bêta-bloquants utilisés par voie générale, s'il est nécessaire d'arrêter le timolol par voie ophtalmique chez des patients ayant une maladie coronarienne, le traitement sera interrompu progressivement.
Autres effets des bêta-bloquants
Hypoglycémie/diabète
Les bêta-bloquants doivent être administrés avec prudence chez les patients sujets à une hypoglycémie spontanée ou chez des patients atteints d'un diabète instable, car les bêta-bloquants peuvent masquer les signes et symptômes d'hypoglycémie aigüe.
Les bêta-bloquants peuvent également masquer les signes d'hyperthyroïdie. Un arrêt brutal du traitement par bêta-bloquants peut précipiter une aggravation des symptômes.
Affections de la cornée
Les bêta-bloquants topiques peuvent induire une sécheresse oculaire. Les patients ayant des affections de la cornée doivent être traités avec prudence.
Anesthésie chirurgicale
Les préparations ophtalmiques contenant des bêta-bloquants peuvent bloquer les effets généraux des bêta-agonistes, par exemple l'adrénaline. Les anesthésistes doivent être informés lorsque le patient est traité par le timolol.
Autres
Le traitement par bêta-bloquants peut aggraver les symptômes d'une myasthénie.
Autres effets de l'inhibition de l'anhydrase carbonique
Le traitement par inhibiteurs de l'anhydrase carbonique par voie générale a été associé à des lithiases urinaires résultant de troubles acidobasiques, particulièrement chez des patients ayant un antécédent de calculs rénaux. Même si l'on n'a pas observé de troubles acidobasiques avec dorzolamide/timolol (formulation avec conservateur), des lithiases urinaires ont été rarement rapportées. COSTEC (formulation sans conservateur) contient un inhibiteur de l'anhydrase carbonique qui est absorbé par voie générale, les patients ayant un antécédent de calculs rénaux peuvent donc présenter un risque accru de lithiases urinaires lors de l'utilisation de ce médicament.
Autres
La prise en charge des patients ayant un glaucome aigu par fermeture de l'angle nécessite en plus des agents hypotenseurs par voie ophtalmique d'autres mesures thérapeutiques. Ce médicament n'a pas été étudié chez les patients porteurs d'un glaucome aigu par fermeture de l'angle.
Un œdème cornéen et une décompensation irréversible de la cornée ont été décrits chez des patients présentant une altération chronique préexistante de la fonction cornéenne et/ou ayant des antécédents de chirurgie intra-oculaire lorsqu'ils sont traités par le dorzolamide. Il existe un risque accru de développer un œdème cornéen. La prescription de COSTEC doit s'effectuer avec précaution chez ce type de patient.
Un décollement de la choroïde a été rapporté au cours de l'administration de traitements diminuant la sécrétion de l'humeur aqueuse (par exemple timolol, acétazolamide) après chirurgie filtrante.
Comme avec d'autres antiglaucomateux, on a observé chez certains patients une diminution de la réponse au maléate de timolol en collyre lors de traitements prolongés. Cependant, dans des études cliniques au cours desquelles 164 patients ont été suivis pendant au moins trois ans, aucune différence significative de la pression intra-oculaire moyenne n'a été observée après stabilisation initiale.
Les patients ayant des antécédents d'hypersensibilité de contact à l'argent ne doivent pas utiliser ce médicament car les gouttes instillées peuvent contenir des traces d'argent provenant du flacon.
Utilisation de lentilles de contact
Ce médicament n'a pas été étudié chez les patients porteurs de lentilles de contact.
Population pédiatrique
Voir rubrique Pharmacodynamie.
INTERACTIONS |
Connectez-vous pour accéder à ce contenu
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Grossesse
COSTEC ne doit pas être utilisé pendant la grossesse.
Dorzolamide
Il n'y a pas de données cliniques disponibles sur l'utilisation chez la femme enceinte.
Le dorzolamide a entraîné des effets tératogènes chez le lapin à des doses maternotoxiques (voir rubrique Sécurité préclinique).
Timolol
Il n'y a pas de données suffisantes d'utilisation du timolol chez la femme enceinte. Le timolol ne doit pas être administré lors de la grossesse sauf en cas de nécessité absolue. Pour la réduction de l'absorption systémique, voir rubrique Posologie et mode d'administration.
Les études épidémiologiques n'ont pas mis en évidence d'effet tératogène, mais ont montré un risque de retard de croissance intra-utérine lorsque les bêta-bloquants sont administrés par voie orale. De plus, des signes et symptômes d'un effet bêta-bloquant (ex. bradycardie, hypotension, détresse respiratoire et hypoglycémie) ont été observés chez des nouveau-nés, après administration de bêta-bloquants jusqu'à l'accouchement. Si ce médicament est administré jusqu'à l'accouchement, le nouveau-né doit être surveillé attentivement durant les premiers jours de la vie.
Allaitement
Il n'y a pas de données concernant l'excrétion de dorzolamide dans le lait maternel. Chez des rates en période de lactation recevant du dorzolamide, on a observé une diminution du poids chez les descendants.
Les bêta-bloquants sont excrétés dans le lait maternel. Cependant, aux doses thérapeutiques du timolol en collyre, il est peu probable qu'une quantité suffisante soit présente dans le lait pour produire les symptômes cliniques des bêta-bloquants chez le nourrisson. Pour la réduction de l'absorption systémique, voir rubrique Posologie et mode d'administration. Si le traitement avec COSTEC est nécessaire, alors l'allaitement n'est pas recommandé.
CONDUITE et UTILISATION DE MACHINES |
Aucune étude sur la capacité à conduire des véhicules et à utiliser des machines n'a été menée. Des effets indésirables possibles tels que vision trouble, peuvent altérer l'aptitude de certains patients à conduire et/ou à utiliser des machines.
EFFETS INDÉSIRABLES |
Connectez-vous pour accéder à ce contenu
SURDOSAGE |
Il n'existe pas de données chez l'homme concernant un surdosage par ingestion accidentelle ou volontaire de dorzolamide/timolol (formulation avec conservateur) ou dorzolamide/timolol (formulation sans conservateur).
Symptômes
Il y a eu des cas de surdosage accidentel avec le maléate de timolol en collyre se traduisant par des effets systémiques identiques à ceux observés avec les bêta-bloquants par voie générale tels que étourdissements, céphalées, essoufflement, bradycardie, bronchospasme, et arrêt cardiaque. Les symptômes les plus fréquents observés avec un surdosage en dorzolamide sont un déséquilibre électrolytique, l'apparition d'une acidose et des effets possibles sur le système nerveux central.
Il n'existe qu'un nombre limité de données disponibles chez l'homme concernant un surdosage par ingestion accidentelle ou volontaire de chlorhydrate de dorzolamide. A la suite d'une ingestion orale, une somnolence a été rapportée. Avec une application locale, les effets suivants ont été rapportés : nausées, étourdissements, céphalées, fatigue, rêves anormaux et dysphagie.
Traitement
Le traitement doit être symptomatique et adapté. Le ionogramme sanguin (en particulier le potassium) et le pH sanguin doivent être surveillés. Les études ont montré que le timolol n'est pas facilement dialysable.
PHARMACODYNAMIE |
Connectez-vous pour accéder à ce contenu
PHARMACOCINÉTIQUE |
Connectez-vous pour accéder à ce contenu
SÉCURITÉ PRÉCLINIQUE |
Le profil de tolérance oculaire et générale des constituants pris séparément est bien établi.
Dorzolamide
Chez des lapins ayant reçu des doses maternotoxiques de dorzolamide associées à une acidose métabolique, des malformations des corps vertébraux ont été observées.
Timolol
Des études chez l'animal n'ont pas montré d'effets tératogènes.
De plus, aucun effet secondaire oculaire chez des animaux traités par voie locale avec du chlorhydrate de dorzolamide et du maléate de timolol administrés seuls ou simultanément n'a été observé. Les études in vitro et in vivo effectuées avec chacun des constituants n'ont pas révélé de pouvoir mutagène.
Par conséquent, aucun risque significatif en matière de tolérance n'est attendu chez l'homme aux doses thérapeutiques de COSTEC.
DURÉE DE CONSERVATION |
2 ans.
Après première ouverture du flacon : 2 mois.
PRÉCAUTIONS PARTICULIÈRES DE CONSERVATION |
A conserver à une température ne dépassant pas 25 °C.
Pour les conditions de conservation après première ouverture du médicament, voir rubrique Durée de conservation.
PRÉCAUTIONS PARTICULIÈRES D'ÉLIMINATION ET DE MANIPULATION |
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Mode d'emploi
Avant instillation du collyre :
L'Instillation :
1. Tenez le flacon juste en dessous du bouchon et tournez le bouchon pour ouvrir le flacon. Ne touchez rien avec l'embout du flacon pour éviter toute contamination de la solution.
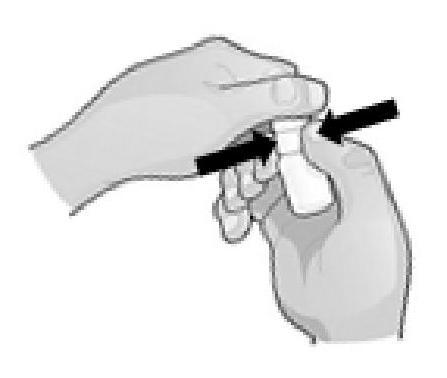
2. Inclinez la tête vers l'arrière et maintenez le flacon au-dessus de votre œil.
3. Tirez la paupière inférieure vers le bas et regardez vers le haut. Pressez doucement le flacon au milieu et laissez une goutte tomber dans votre œil. Veuillez noter qu'il pourrait y avoir quelques secondes de délai entre le moment où vous pressez le flacon et le moment où la goutte tombe. Ne serrez pas trop fort.
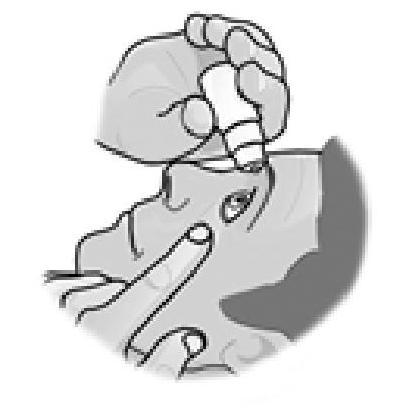
4. Fermez votre œil et appuyez sur le coin intérieur de l'œil avec votre doigt pendant environ 2 minutes. Cela aide à stopper la propagation du médicament dans le reste du corps.

5. Répétez les instructions 2-4 pour instiller une goutte dans l'autre œil, si votre médecin vous a demandé de le faire. Parfois, un seul œil doit être traité, votre médecin vous indiquera si cela s'applique à vous et quel œil a besoin d'un traitement.
6. Après chaque utilisation et avant de remettre le bouchon, le flacon doit être secoué une fois vers le bas, sans toucher l'extrémité du compte-gouttes, afin d'enlever tout résidu de liquide sur l'embout. Cela est nécessaire afin de pouvoir instiller des gouttes ultérieurement.
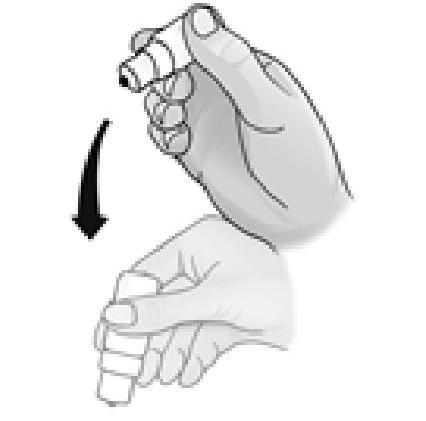
7. Essuyez tout excès de solution sur la peau autour de l'œil.
8. À la fin des 2 mois d'utilisation du médicament, il restera un peu de COSTEC dans le flacon. N'essayez pas d'utiliser l'excédent de médicament restant dans le flacon après avoir terminé votre traitement. Ne pas utiliser le collyre plus de 2 mois après la première ouverture du flacon.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| AMM |
|
| Prix : |
|