Veuillez saisir au moins 3 caractères pour votre recherche.
- Médicaments
- CUROSURF
- CUROSURF 120 mg/1,5 ml susp p instil ETB
Mise à jour : 20 décembre 2019
Sommaire
SYNTHÈSE |
Cip : 3400955775201
Modalités de conservation : Avant ouverture : 2° < t < 8° durant 18 mois (Conserver à l'abri de la lumière, Conserver dans son emballage, Conserver au réfrigérateur)
FORMES et PRÉSENTATIONS |
COMPOSITION |
| p flacon | ||
| de 1,5 ml | de 3 ml | |
| Poractant alfa* | 120 mg | 240 mg |
INDICATIONS |
POSOLOGIE ET MODE D'ADMINISTRATION |
Connectez-vous pour accéder à ce contenu
CONTRE-INDICATIONS |
Connectez-vous pour accéder à ce contenu
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
Curosurf doit être administré par des praticiens entraînés et expérimentés dans les soins et la réanimation des enfants prématurés.
Curosurf doit être administré à des enfants intubés en ventilation mécanique ou sous assistance respiratoire non invasive et sous surveillance constante de leur oxymétrie par mesure de la PO2 par électrode transcutanée.
Les enfants nés après une rupture très prolongée des membranes (plus de 3 semaines) peuvent ne pas présenter une réponse optimale au traitement du fait de l'hypoplasie pulmonaire souvent associée.
Précautions d'emploi :Il est recommandé de pratiquer une radiographie pulmonaire, afin de vérifier la bonne position de la sonde intratrachéale et l'absence de pneumothorax.
L'administration de Curosurf nécessite un contrôle rigoureux et permanent des constantes de ventilation et d'oxygénation.
Du fait des propriétés tensioactives de Curosurf, l'expansion thoracique peut augmenter rapidement après l'administration du produit, ce qui nécessite une diminution rapide de la pression respiratoire maximale de ventilation.
L'amélioration de la mécanique pulmonaire provenant du traitement par Curosurf peut entraîner une augmentation rapide de la pression partielle d'oxygène dans le sang artériel et donc nécessiter une diminution rapide de la concentration de l'oxygène inspiré, afin d'éviter une hyperoxie dont les dangers, en particulier rétiniens, sont à redouter chez les prématurés (risques de cécité).
Technique d'administration LISA : Une augmentation de la fréquence de survenue de bradycardie, d'apnée et de diminution de la saturation en oxygène a été rapportée plus fréquemment lorsque Curosurf était administré avec la méthode LISA. Ces évènements ont été en général de courte durée, sans conséquences pendant l'administration et facilement contrôlés.
Si ces évènements présentent des critères de gravité le traitement par surfactant devra être interrompu.
Ce médicament contient moins d'1 mmol (23 mg) de sodium par flacon, c'est-à-dire qu'il est essentiellement « sans sodium ».
EFFETS INDÉSIRABLES |
Connectez-vous pour accéder à ce contenu
SURDOSAGE |
Les effets d'un surdosage ne sont pas encore connus. Cependant, il est tout à fait déconseillé d'administrer une dose totale supérieure à 400 mg/kg.
En cas de surdosage accidentel, la suspension devra être aspirée et une surveillance spécifique de la balance lipidique et électrolytique devra être instaurée.
PHARMACODYNAMIE |
Connectez-vous pour accéder à ce contenu
PHARMACOCINÉTIQUE |
Connectez-vous pour accéder à ce contenu
INCOMPATIBILITÉS |
En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé avec d'autres médicaments.
MODALITÉS DE CONSERVATION |
Après ouverture : le produit doit être utilisé immédiatement.
A conserver au réfrigérateur (entre 2 °C et 8 °C) et dans la boîte carton d'origine à l'abri de la lumière.
Pendant sa durée de conservation, le produit peut être sorti du réfrigérateur pour une période de 24 heures maximum à une température ne dépassant pas 25 °C. A la fin de cette période, le flacon de Curosurf non utilisé, non ouvert peut être remis au réfrigérateur pour un usage ultérieur.
Ce flacon ne peut être remis au réfrigérateur plus d'une fois. Après la deuxième sortie du réfrigérateur, le produit devra être utilisé dans les 24 heures ou être jeté.
La date et l'heure de sortie du réfrigérateur doivent être enregistrées sur l'emballage extérieur.
MODALITÉS MANIPULATION/ÉLIMINATION |
Avant utilisation, le flacon doit être amené à 37 °C, puis agité doucement de haut en bas afin d'obtenir une suspension uniforme.
La suspension doit être extraite du flacon au moyen d'une aiguille et d'une seringue stérile.
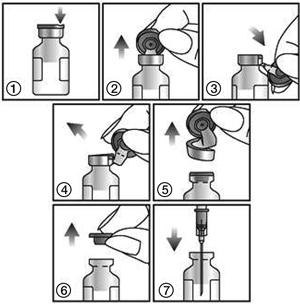
Afin d'extraire la suspension, respecter les instructions ci-dessous :
1. Repérer l'encoche (FLIP-UP) sur la capsule en plastique colorée.
2. Soulever l'encoche et tirer vers le haut.
3. Soulever la capsule en plastique et tirer la partie d'aluminium vers le bas.
4. et 5. Oter l'ensemble de l'anneau en tirant sur l'aluminium.
6. et 7. Oter la capsule de caoutchouc afin d'extraire le contenu.
Pour usage unique seulement.
 |
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| Médicament réservé à l'usage hospitalier. Prescription réservée aux unités de soins intensifs en néonatalogie. | |
| AMM | 3400955775201 (1992, RCP rév 14.06.2018) 120 mg/1,5 ml. |
| 3400955775379 (1992, RCP rév 14.06.2018) 240 mg/3 ml. | |
| Collect. |
