Veuillez saisir au moins 3 caractères pour votre recherche.
- Médicaments
- DOGMATIL
- DOGMATIL 0,5 g/100 ml sol buv sans sucre édulcorée au cyclamate de sodium
Mise à jour : 03 septembre 2024
Sommaire
SYNTHÈSE |
aromatisant : citron arôme
EEN sans dose seuil : p-hydroxybenzoate de méthyle, p-hydroxybenzoate de propyle
EEN avec dose seuil : sodium
Cip : 3400930329054
Modalités de conservation : Avant ouverture : < 25° durant 36 mois
FORMES et PRÉSENTATIONS |
Solution buvable.
Boîte contenant : 1 flacon de 200 ml + 1 godet gradué.
COMPOSITION |
Pour 100 ml :
Sulpiride base : 0,5 g
Excipients à effet notoire : sodium 2,855 mg par ml, parahydroxybenzoate et éthanol 47,85 mg par dose de 25 mg.
Acide chlorhydrique concentré, hydroxyéthylcellulose, cyclamate de sodium, acide sorbique, parahydroxybenzoate de méthyle, parahydroxybenzoate de propyle, acide citrique monohydraté, arôme citron (contenant de l'éthanol), eau purifiée.
INDICATIONS |
Chez l'adulte :
Traitement symptomatique de courte durée de l'anxiété en cas d'échec des thérapeutiques habituelles.
Chez l'enfant :
Troubles graves du comportement (agitation, automutilations, stéréotypies) notamment dans le cadre des syndromes autistiques.
POSOLOGIE ET MODE D'ADMINISTRATION |
Connectez-vous pour accéder à ce contenu
CONTRE-INDICATIONS |
Connectez-vous pour accéder à ce contenu
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
Mises en garde spéciales
Syndrome malin des neuroleptiques potentiellement fatal :
Un syndrome malin des neuroleptiques potentiellement fatal, signalé en rapport avec les antipsychotiques est caractérisé par une hyperthermie, pâleur, troubles végétatifs, altération de la conscience, une rigidité musculaire, une rhabdomyolyse, des taux sériques élevés de créatine phosphokinase et une dysautonomie. Des cas avec des caractéristiques atypiques telles que l'hyperthermie sans la rigidité musculaire ou l'hypertonie, ont été observés. Dans le cas d'hyperthermie d'origine non diagnostiquée, qui peut être considéré comme un signe/symptôme précurseur du syndrome malin des neuroleptiques ou comme un syndrome malin des neuroleptiques atypique, tout traitement par sulpiride et tous les autres médicaments antipsychotiques doit être interrompu rapidement sous surveillance médicale.
Les signes de dysfonctionnement végétatif, tels que sudation et instabilité artérielle, peuvent précéder l'apparition de l'hyperthermie et constituer, par conséquent, des signes d'appel précoces. Bien que cet effet des neuroleptiques puisse avoir une origine idiosyncrasique, certains facteurs de risque semblent y prédisposer, tels que la déshydratation ou des atteintes organiques cérébrales.
Allongement de l'intervalle QT :
Le sulpiride prolonge de façon dose-dépendante l'intervalle QT. Cet effet, connu pour potentialiser le risque de survenue de troubles du rythme ventriculaire graves notamment à type de torsades de pointe, est majoré par l'existence d'une bradycardie, d'une hypokaliémie, d'un QT long congénital ou acquis (association à un médicament augmentant l'intervalle QT) (voir rubrique Effets indésirables)
Il convient donc, lorsque la situation clinique le permet, de s'assurer avant toute administration de l'absence de facteurs pouvant favoriser la survenue de ce trouble du rythme :
Hormis les situations d'urgence, il est recommandé d'effectuer un électrocardiogramme (ECG) dans le bilan initial des patients devant être traités par un neuroleptique.
Accident vasculaire cérébral :
Dans des études cliniques randomisées versus placebo réalisées chez des patients âgés atteints de démence et traités avec certains antipsychotiques atypiques, il a été observé un risque plus élevé d'accident vasculaire cérébral comparé au placebo. Le mécanisme d'une telle augmentation de risque n'est pas connu. Une élévation du risque avec d'autres antipsychotiques ou chez d'autres populations de patients ne peut être exclue. Ce médicament doit être utilisé avec prudence chez les patients présentant des facteurs de risque d'accident vasculaire cérébral.
Patients âgés déments :
Le risque de mortalité est augmenté chez les patients âgés atteints de psychose associée à une démence et traités par antipsychotiques.
Les analyses de 17 études contrôlées versus placebo (durée moyenne de 10 semaines), réalisées chez des patients prenant majoritairement des antipsychotiques atypiques, ont mis en évidence un risque de mortalité 1,6 à 1,7 fois plus élevé chez les patients traités par ces médicaments comparativement au placebo.
A la fin du traitement d'une durée moyenne de 10 semaines, le risque de mortalité a été de 4,5 % dans le groupe de patients traités comparé à 2,6 % dans le groupe placebo.
Bien que les causes de décès dans les essais cliniques avec les antipsychotiques atypiques aient été variées, la plupart de ces décès semblaient être soit d'origine cardiovasculaire (par exemple insuffisance cardiaque, mort subite) soit d'origine infectieuse (par exemple pneumonie).
Des études épidémiologiques suggèrent que, comme avec les antipsychotiques atypiques, le traitement avec les antipsychotiques classiques peut augmenter la mortalité.
La part respective de l'antipsychotique et des caractéristiques des patients dans l'augmentation de la mortalité dans les études épidémiologiques n'est pas claire.
Thromboembolie veineuse :
Des cas de thromboembolies veineuses (TEV) ont été rapportés avec les antipsychotiques. Les patients traités par des antipsychotiques présentant souvent des facteurs de risque acquis de TEV, tout facteur de risque potentiel de TEV doit être identifié avant et pendant le traitement par DOGMATIL et des mesures préventives doivent être mises en œuvre (voir rubrique Effets indésirables).
Cancer du sein :
Le sulpiride peut augmenter les taux de prolactine. Il doit donc être utilisé avec précaution. Quel que soit leur sexe, les patients ayant des antécédents personnels ou familiaux de cancer du sein doivent être étroitement surveillés pendant le traitement par sulpiride.
Diminution du péristaltisme intestinal :
Des cas d'obstruction intestinale ont été rapportés chez des patients traités par des antipsychotiques. De rares cas de colite ischémique et de nécrose intestinale, d'évolution parfois fatale, ont également été rapportés. La majorité de ces patients étaient traités de façon concomitante avec un ou plusieurs médicaments induisant une diminution de la motilité intestinale (en particulier les médicaments ayant des propriétés anticholinergiques). L'apparition de douleurs abdominales avec vomissements et/ou diarrhée doit attirer l'attention. Il est impératif que la constipation soit reconnue et traitée activement. La survenue d'un iléus/une obstruction intestinale doit nécessiter une prise en charge en urgence.
Autres mises en garde :
La prise de ce médicament est déconseillée en association avec l'alcool, la lévodopa, les antiparkinsoniens dopaminergiques, les antiparasitaires susceptibles de donner des torsades de pointe, la méthadone, d'autres neuroleptiques et médicaments susceptibles de donner des torsades de pointe (voir rubrique Interactions).
Il est nécessaire de tenir compte du risque d'apparition de dyskinésies tardives, même avec de faibles doses, notamment chez le sujet âgé.
Chez l'enfant, l'efficacité et la tolérance n'ayant pas été complètement étudiées, des précautions devront être prises lors de l'utilisation du sulpiride (voir rubrique Posologie et mode d'administration). Du fait du retentissement cognitif, un examen clinique annuel évaluant les capacités d'apprentissage est recommandé. La posologie sera régulièrement adaptée en fonction de l'état clinique de l'enfant.
L'utilisation chez l'enfant de moins de 6 ans sera réservée à des situations exceptionnelles, en milieu spécialisé.
Excipients à effet notoire :
Ce médicament contient du parahydroxybenzoate et peut provoquer des réactions allergiques (éventuellement retardées).
Ce médicament contient 2,855 mg de sodium par ml (correspondant à 5 mg de sulpiride base) de solution buvable, ce qui équivaut à 0,143 % de l'apport alimentaire quotidien maximal recommandé par l'OMS de 2 g de sodium par adulte.
Ce médicament contient 47,85 mg d'éthanol par dose de 25 mg (5 ml de solution buvable) équivalent à 9,57 mg par ml (0,957 % p/v). La quantité d'éthanol dans 5 ml de ce médicament est équivalente à 1,196 ml de bière ou 0,478 ml de vin.
La quantité d'éthanol contenue dans ce médicament n'est pas susceptible d'avoir un effet chez les adultes et les adolescents, et est peu susceptible d'avoir un effet notable chez les enfants. Chez les jeunes enfants, certains effets peuvent survenir comme par exemple la somnolence.
L'éthanol contenu dans ce médicament peut modifier les effets d'autres médicaments (voir rubrique Interactions).
Il doit être pris en compte chez les personnes souffrant d'alcoolisme, chez les femmes enceintes ou qui allaitent et chez les enfants.
Précautions d'emploi
Les patients diabétiques et les patients ayant des facteurs de risque de diabète, et qui débutent un traitement par sulpiride, doivent faire l'objet d'une surveillance glycémique appropriée.
En dehors de situations exceptionnelles, ce médicament ne doit pas être utilisé en cas de maladie de Parkinson.
En cas d'insuffisance rénale, réduire la posologie et renforcer la surveillance ; en cas d'insuffisance rénale grave, il est recommandé de prescrire des cures discontinues.
La surveillance du traitement par sulpiride doit être renforcée :
Des cas de leucopénie, neutropénie et agranulocytose ont été rapportés avec les antipsychotiques dont DOGMATIL. Des infections inexpliquées ou de la fièvre inexpliquée peuvent être révélateurs d'une leucopénie (voir rubrique Effets indésirables) et nécessiter la réalisation de bilans sanguins immédiats.
DOGMATIL doit être utilisé avec prudence chez les patients ayant un antécédent de glaucome, d'iléus, de sténose digestive congénitale, de rétention urinaire ou d'hyperplasie de la prostate.
DOGMATIL doit être utilisé avec prudence chez les patients hypertendus, et plus particulièrement chez le sujet âgé, en raison du risque de crise hypertensive. Une surveillance adéquate doit être mise en place chez ces patients.
INTERACTIONS |
Connectez-vous pour accéder à ce contenu
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Grossesse
Les données sur l'utilisation du sulpiride chez la femme enceinte sont très limitées. La sécurité d'emploi de sulpiride au cours de la grossesse n'a pas été établie.
Le sulpiride traverse le placenta. Les études chez l'animal ont montré une toxicité sur la fonction de reproduction.
L'utilisation de sulpiride n'est pas recommandée pendant la grossesse et chez les femmes en âge de procréer n'utilisant pas de contraception efficace, sauf si les bénéfices attendus justifient les risques potentiels encourus.
Les nouveau-nés exposés aux antipsychotiques (dont DOGMATIL) au cours du troisième trimestre de la grossesse, présentent un risque d'événements indésirables incluant des symptômes extrapyramidaux et/ou des symptômes de sevrage, pouvant varier en termes de sévérité et de durée après la naissance (voir rubrique Effets indésirables). Les réactions suivantes ont été rapportées : agitation, hypertonie, hypotonie, tremblements, somnolence, détresse respiratoire, troubles de l'alimentation. En conséquence, les nouveau-nés doivent être étroitement surveillés.
Allaitement
Le sulpiride est excrété dans le lait maternel en quantité assez importante, dépassant dans certains cas la valeur acceptée de 10 % de la posologie ajustée en fonction du poids de la mère, mais les concentrations dans le sang chez les nourrissons nourris au sein n'ont pas été évaluées. Les informations sur les effets de sulpiride chez les nouveau-nés/nourrissons sont insuffisantes.
Il faut décider d'interrompre l'allaitement ou de ne pas prendre de sulpiride en tenant compte du bénéfice de l'allaitement pour l'enfant et du bénéfice du traitement pour la femme.
Fertilité
Une diminution de la fertilité liée aux effets pharmacologiques du médicament (effet dépendant de la prolactine) a été observée chez les animaux traités.
CONDUITE et UTILISATION DE MACHINES |
L'attention est attirée, notamment chez les conducteurs de véhicules et les utilisateurs de machines, sur les risques de somnolence attachés à l'emploi de ce médicament (voir rubrique Effets indésirables).
EFFETS INDÉSIRABLES |
Connectez-vous pour accéder à ce contenu
SURDOSAGE |
L'expérience avec le sulpiride en cas de surdosage est limitée. Des dyskinésies avec torticolis spasmodique, protrusion de la langue et trismus peuvent apparaître. Certains patients peuvent développer un syndrome parkinsonien pouvant mettre en jeu le pronostic vital, voire un coma.
Des cas d'issue fatale ont été rapportés, principalement en cas d'association avec d'autres substances psychotropes.
Le sulpiride est partiellement éliminé par hémodialyse.
Il n'existe pas d'antidote spécifique au sulpiride.
Traitement symptomatique, réanimation sous étroite surveillance respiratoire et cardiaque continue (risque d'allongement de l'intervalle QT et d'arythmie ventriculaire) qui sera poursuivie jusqu'à rétablissement du patient.
Si un syndrome extrapyramidal sévère apparaît, administrer un anticholinergique.
PHARMACODYNAMIE |
Connectez-vous pour accéder à ce contenu
PHARMACOCINÉTIQUE |
Connectez-vous pour accéder à ce contenu
DURÉE DE CONSERVATION |
3 ans
PRÉCAUTIONS PARTICULIÈRES DE CONSERVATION |
A conserver à une température ne dépassant pas 25 °C.
PRÉCAUTIONS PARTICULIÈRES D'ÉLIMINATION ET DE MANIPULATION |
Ce médicament s'administre par voie orale uniquement à l'aide du godet fourni avec le flacon dans la boîte.
La mention « DOGMATIL 0,5 g/100 ml » est apposée sur le bas du godet.
Le godet est transparent et gradué de 25 mg à 75 mg, tous les 5 mg. Les graduations sont visibles sur son pourtour.
1 ml de solution correspond à 5 mg de sulpiride base.
Ouvrir le flacon de DOGMATIL 0,5 g/100 ml SANS SUCRE.
La dose à administrer pour une prise est obtenue en versant dans le godet la quantité de solution buvable requise jusqu'à atteindre la graduation de la dose prescrite.
Par exemple : pour obtenir une dose à administrer de 50 mg, verser le contenu du flacon dans le godet jusqu'à la graduation 50 mg.
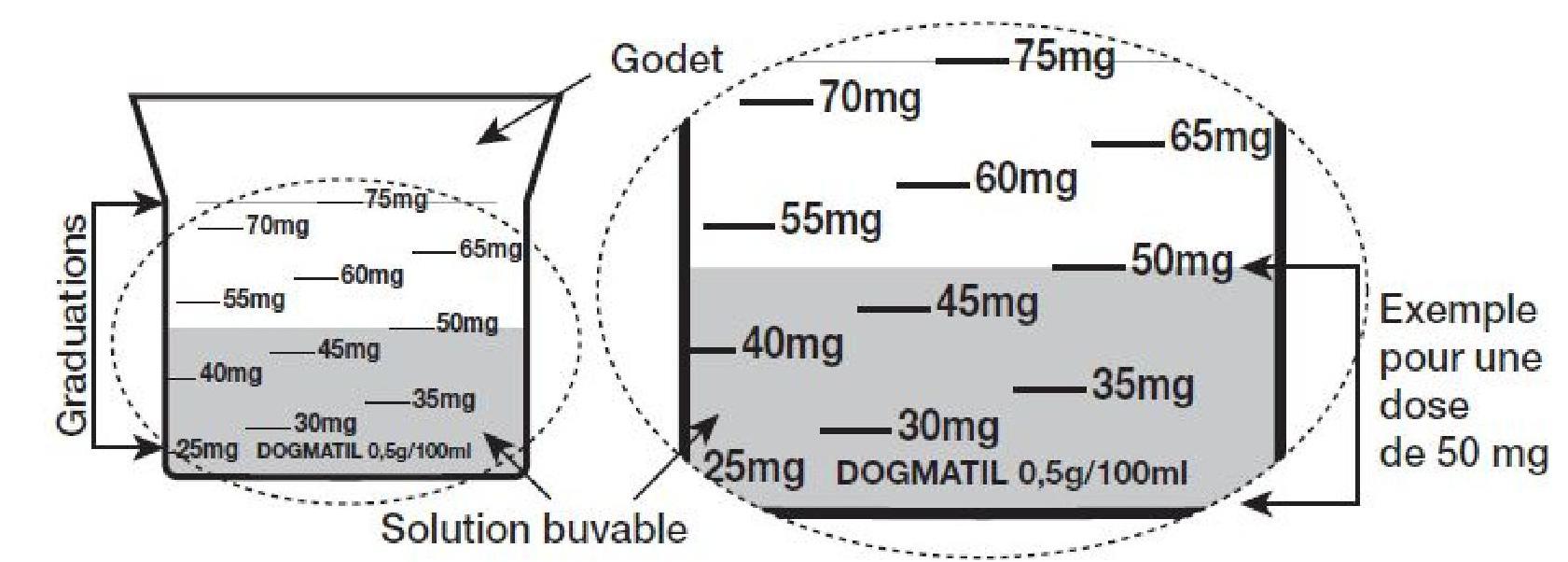
Après utilisation, refermer le flacon, bien rincer le godet avec de l'eau et le sécher. Puis ranger immédiatement le godet dans la boîte dans un endroit inaccessible aux enfants. Ne jamais séparer le godet des autres éléments de conditionnement du médicament (flacon, notice, boîte). L'usage du godet est exclusivement réservé à l'administration de DOGMATIL 0,5 g/100 ml SANS SUCRE.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| AMM |
|
| Prix : |
|