Veuillez saisir au moins 3 caractères pour votre recherche.
- Médicaments
- ENOXAPARINE TEVA
- ENOXAPARINE TEVA 8000 UI (80 mg)/0,8 ml sol inj en seringue préremplie
Mise à jour : 22 août 2024
Sommaire
SYNTHÈSE |
Cip : 3400930245101
Modalités de conservation : Avant ouverture : < 25° durant 36 mois (Ne pas congeler, Eliminer toute fraction restante de manière appropriée)
Cip : 3400930245071
Modalités de conservation : Avant ouverture : < 25° durant 36 mois (Ne pas congeler, Eliminer toute fraction restante de manière appropriée)
FORMES et PRÉSENTATIONS |
Solution injectable (liquide transparent incolore ou jaune clair, le pH de la solution se situe entre 5,5 et 7,5).
Seringue préremplie* contenant 0,8 mL de solution injectable, avec aiguille fixée avec capuchon protecteur et gaine d'aiguille fermée par un bouchon, et munie d'un piston marron (avec ou sans dispositif de sécurité).
Boîte de 2 ou de 10.
* Seringues graduées.
COMPOSITION |
Seringues préremplies :
8 000 UI (80 mg)/0,8 mL
Chaque seringue préremplie contient 8 000 UI d'activité anti-Xa (correspondant à 80 mg) d'énoxaparine sodique dans 0,8 mL d'eau pour préparations injectables.
L'énoxaparine sodique est une substance biologique obtenue par dépolymérisation alcaline d'ester benzylique d'héparine dérivé de la muqueuse intestinale porcine.
Eau pour préparations injectables.
INDICATIONS |
ENOXAPARINE TEVA 8 000 UI (80 mg)/0,8 mL, solution injectable en seringue préremplie est indiqué chez l'adulte dans :
POSOLOGIE ET MODE D'ADMINISTRATION |
Connectez-vous pour accéder à ce contenu
CONTRE-INDICATIONS |
Connectez-vous pour accéder à ce contenu
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
L'énoxaparine sodique n'est pas interchangeable (unité pour unité) avec d'autres HBPM. Ces médicaments diffèrent par leurs procédés de fabrication, leurs poids moléculaires, leurs activités anti-Xa et anti-IIa spécifiques, leurs unités, leurs posologies et leur efficacité clinique et sécurité d'emploi. Cela se traduit par des différences au niveau de leurs propriétés pharmacocinétiques et activités biologiques associées (par ex., activité antithrombine et interactions avec les plaquettes). Par conséquent, une attention particulière et un respect des règles de bon usage spécifiques à chaque médicament sont nécessaires.
L'utilisation d'énoxaparine sodique chez les patients ayant des antécédents de TIH à médiation immunitaire au cours des 100 derniers jours ou en présence d'anticorps circulants est contre-indiquée (voir rubrique Contre-indications). Les anticorps circulants peuvent persister plusieurs années.
L'énoxaparine sodique doit être utilisée avec une extrême prudence chez les patients ayant des antécédents (> 100 jours) de thrombopénie induite par héparine sans anticorps circulants. La décision d'utiliser de l'énoxaparine sodique dans de tels cas doit être prise uniquement après une évaluation soigneuse du rapport bénéfice-risque et après avoir envisagé des alternatives thérapeutiques non hépariniques (par ex., danaparoïde sodique ou lépirudine).
Chez les patients atteints d'un cancer avec une numération plaquettaire inférieure à 80 g/L, un traitement anticoagulant ne peut être envisagé qu'au cas par cas et une surveillance étroite est recommandée.
Le risque de TIH médiée par des anticorps existe également avec les HBPM. En cas de survenue de thrombopénie, elle se manifeste généralement entre le 5e et le 21e jour après le début du traitement par énoxaparine sodique.
Le risque de TIH est plus élevé chez les patients postopératoires et principalement après une intervention cardiaque ainsi que chez les patients atteints de cancer.
Il est donc recommandé de réaliser une numération plaquettaire avant l'instauration du traitement par énoxaparine sodique, puis régulièrement par la suite au cours du traitement.
En cas de symptômes cliniques suggérant une TIH (tout nouvel épisode de thromboembolie artérielle et/ou veineuse, toute lésion cutanée douloureuse au site d'injection, toute réaction allergique ou anaphylactoïde sous traitement), une numération plaquettaire doit être réalisée. Les patients doivent être informés que ces symptômes peuvent survenir et dans ce cas, ils doivent en informer leur médecin traitant.
En pratique, si une diminution significative confirmée de la numération plaquettaire est observée (30 à 50 % de la valeur initiale), le traitement par énoxaparine sodique doit être immédiatement interrompu et relayé par un autre traitement anticoagulant non héparinique.
Comme avec d'autres anticoagulants, des saignements peuvent se produire dans n'importe quel site. En cas de saignement, l'origine de l'hémorragie doit être recherchée et un traitement approprié doit être instauré.
L'énoxaparine sodique, comme tout autre anticoagulant, doit être utilisée avec prudence dans les situations associées à un risque accru de saignement telles que :
Aux doses utilisées pour le traitement prophylactique de la maladie thromboembolique veineuse, l'énoxaparine sodique n'a pas d'influence significative sur le temps de saignement, les tests de coagulation sanguine globale, l'agrégation plaquettaire et sur la liaison du fibrinogène aux plaquettes.
À des doses plus élevées, des augmentations du temps de céphaline activée (TCA) et du temps de coagulation activée (ACT) peuvent se produire. Ces augmentations du TCA et de l'ACT ne sont pas corrélées de façon linéaire avec l'augmentation de l'activité antithrombotique de l'énoxaparine sodique et, par conséquent ne permettent pas de contrôler l'activité de l'énoxaparine sodique.
Les anesthésies rachidiennes/péridurales ou les ponctions lombaires ne doivent pas être pratiquées dans les 24 heures suivant l'administration d'énoxaparine sodique à des doses curatives (voir également la rubrique Contre-indications).
Des cas d'hématomes intrarachidiens ont été signalés lors de l'utilisation d'énoxaparine sodique lors d'une anesthésie rachidienne/péridurale ou de ponctions lombaires ayant entraîné une paralysie prolongée ou permanente. Ces événements sont rares avec les schémas posologiques d'énoxaparine sodique de 4 000 UI (40 mg) une fois par jour ou à une dose inférieure. Le risque de survenue de ces événements est plus élevé avec l'utilisation postopératoire de cathéters périduraux implantés, avec l'utilisation concomitante de traitements modifiant l'hémostase, tels que les anti-inflammatoires non stéroïdiens (AINS), en cas de procédure péridurale ou de ponction lombaire traumatique ou répétée, ou chez les patients présentant des antécédents de chirurgie rachidienne ou de malformation rachidienne.
Il faut tenir compte du profil pharmacocinétique de l'énoxaparine sodique pour réduire le risque potentiel de saignement associé à l'utilisation d'énoxaparine sodique lors d'une anesthésie/analgésie péridurale ou rachidienne ou d'une rachicentèse (voir la rubrique Pharmacocinétique). La pose ou le retrait d'un cathéter péridural ou une ponction lombaire sont à réaliser de préférence lorsque l'effet anticoagulant de l'énoxaparine sodique est faible. Toutefois, le délai exact pour atteindre un effet anticoagulant suffisamment faible chez chaque patient n'est pas connu. Pour les patients présentant une clairance de la créatinine de [15 à 30 mL/minute], d'autres paramètres doivent être pris en compte, en raison d'une élimination plus lente de l'énoxaparine sodique (voir la rubrique Posologie et mode d'administration).
Si le traitement anticoagulant est administré dans le cadre d'une anesthésie/analgésie péridurale ou rachidienne ou d'une ponction lombaire, un suivi fréquent doit être mis en place afin de déceler tout signe et symptôme d'une atteinte neurologique, tel qu'une douleur dorsale au niveau de la colonne vertébrale, des déficits moteurs et sensoriels (engourdissement ou faiblesse au niveau des membres inférieurs), un dysfonctionnement des intestins et/ou de la vessie. Les patients doivent être informés qu'ils doivent signaler immédiatement tout signe ou symptôme décrit ci-dessus. Si des signes ou symptômes d'hématome rachidien sont suspectés, il est urgent de poser le diagnostic et d'initier un traitement, notamment envisager une décompression de la moelle épinière, même s'il est possible que ce traitement ne parvienne pas à prévenir ou à récupérer les séquelles neurologiques.
Des cas de nécrose et de vascularite cutanées ont été signalés avec des HBPM et doivent conduire à un arrêt rapide du traitement.
Des pustuloses exanthématiques aiguës généralisées (PEAG) ont été rapportées avec une fréquence inconnue en association avec le traitement par énoxaparine. Au moment de la prescription, les patients doivent être informés des signes et des symptômes et doivent faire l'objet d'une surveillance étroite pour détecter ces réactions cutanées. Si des signes et des symptômes évocateurs de ces réactions apparaissent, l'énoxaparine doit être arrêtée immédiatement et un traitement alternatif doit être envisagé (le cas échéant).
Afin de minimiser le risque de saignement suite à une procédure vasculaire pendant la prise en charge d'un angor instable, d'un NSTEMI et d'un STEMI aigu, les intervalles de temps recommandés entre les doses d'injection d'énoxaparine sodique doivent être respectés précisément. Il est important d'atteindre l'hémostase au site de ponction après une ICP. Si un dispositif de fermeture est utilisé, la gaine peut être immédiatement retirée. Si une méthode de compression manuelle est utilisée, la gaine doit être retirée 6 heures après la dernière injection IV/SC d'énoxaparine sodique. Si le traitement par énoxaparine sodique doit se poursuivre, la dose suivante programmée doit être administrée au plus tôt 6 à 8 heures après le retrait de la gaine. Le site de la procédure doit être surveillé pour déceler tout signe de saignement ou de formation d'un hématome.
L'utilisation d'héparine n'est généralement pas recommandée chez les patients atteints d'endocardite infectieuse aiguë en raison du risque d'hémorragie cérébrale. Si une telle utilisation est considérée comme étant absolument nécessaire, la décision doit être prise uniquement après une évaluation prudente du rapport bénéfice-risque.
Il n'existe pas d'étude spécifique sur l'utilisation d'énoxaparine sodique pour la thromboprophylaxie chez les patients porteurs de prothèses valvulaires cardiaques mécaniques. Des cas isolés de thrombose sur prothèses de valve mécaniques ont été signalés chez des patients ayant reçu de l'énoxaparine sodique en thromboprophylaxie. Des facteurs confondants, incluant la maladie sous-jacente et des données cliniques limitées, ne permettent pas d'évaluer correctement ces cas. Dans certains cas, il s'agissait de femmes enceintes chez lesquelles la thrombose a entraîné le décès de la mère et du fœtus.
L'utilisation d'énoxaparine sodique en thromboprophylaxie chez les femmes enceintes porteuses de prothèses valvulaires cardiaques mécaniques n'a pas été étudiée de façon spécifique. Dans le cadre d'une étude clinique chez des femmes enceintes porteuses de prothèses valvulaires cardiaques mécaniques traitées par énoxaparine sodique (100 UI/kg [1 mg/kg], 2 fois par jour) pour réduire le risque thromboembolique, 2 femmes sur 8 ont développé des caillots résultant en un blocage de la valve et entraînant le décès de la mère et du fœtus. Des cas isolés de thrombose de valves ont été rapportés post-commercialisation chez des femmes enceintes porteuses de prothèses valvulaires cardiaques mécaniques traitées par énoxaparine sodique en thromboprophylaxie. Les femmes enceintes porteuses de prothèses valvulaires cardiaques mécaniques peuvent être à haut risque thromboembolique.
Aucune tendance d'augmentation des saignements n'est observée chez les patients âgés traités à doses prophylactiques. Les patients âgés (en particulier les patients âgés de 80 ans et plus) pourraient présenter un risque accru de complications hémorragiques aux doses thérapeutiques. Une surveillance clinique étroite est recommandée, et une diminution de la posologie chez les patients âgés de plus de 75 ans traités pour un STEMI pourrait être envisagée (voir les rubriques Posologie et mode d'administration et Pharmacocinétique).
Chez les patients présentant une insuffisance rénale, l'exposition à l'énoxaparine est augmentée, associée à une élévation du risque de saignement. Chez ces patients, une surveillance clinique étroite est recommandée, et une surveillance biologique par la mesure de l'activité anti-Xa pourrait être envisagée (voir les rubriques Posologie et mode d'administration et Pharmacocinétique).
En raison du manque de données dans cette population, l'énoxaparine sodique n'est pas recommandée chez les patients atteints d'une insuffisance rénale terminale (clairance de la créatinine < 15 mL/min) en dehors de la prévention de la formation d'un thrombus dans le circuit de circulation extracorporelle au cours de l'hémodialyse.
Chez les patients atteints d'insuffisance rénale sévère (clairance de la créatinine de 15 à 30 mL/min), il est recommandé d'ajuster la posologie pour les traitements curatif et prophylactique (voir rubrique Posologie et mode d'administration), en raison d'une exposition à l'énoxaparine sodique significativement augmentée.
Aucun ajustement posologique n'est recommandé chez les patients atteints d'insuffisance rénale modérée (clairance de la créatinine de 30 à 50 mL/min) et légère (clairance de la créatinine de 50 à 80 mL/min).
L'énoxaparine sodique doit être utilisée avec précaution chez les patients ayant une insuffisance hépatique, en raison du risque augmenté de saignements. Une adaptation de la posologie, sur la base d'une surveillance de l'activité anti-Xa, n'est pas fiable chez les patients avec une cirrhose hépatique et n'est pas recommandée (voir rubrique Pharmacocinétique).
Une augmentation de l'exposition à l'énoxaparine sodique avec des doses prophylactiques (non ajustées en fonction du poids) a été observée chez des femmes et des hommes de faible poids corporel (< 45 kg et < 57 kg respectivement), ce qui pourrait augmenter le risque hémorragique. Une surveillance clinique étroite est donc recommandée chez ces patients (voir rubrique Pharmacocinétique).
Les patients obèses ont un risque thromboembolique plus élevé. La sécurité d'emploi et l'efficacité des doses prophylactiques chez les patients obèses (IMC > 30 kg/m2) n'ont pas été entièrement déterminées et il n'existe aucun consensus sur l'ajustement de la posologie. Ces patients doivent faire l'objet d'une surveillance étroite pour déceler tout signe ou symptôme de maladie thromboembolique.
Les héparines peuvent supprimer la sécrétion surrénale d'aldostérone et entraîner une hyperkaliémie (voir rubrique Effets indésirables), en particulier chez les patients atteints de diabète, présentant une insuffisance rénale chronique, une acidose métabolique préexistante, prenant des médicaments connus pour augmenter les taux de potassium (voir rubrique Interactions). Les taux plasmatiques de potassium doivent être régulièrement surveillés, en particulier chez les patients à risque.
Les HBPM sont des médicaments biologiques. Afin d'améliorer la traçabilité des HBPM, il est recommandé aux professionnels de santé de consigner le nom commercial et le numéro de lot du produit administré dans le dossier médical du patient.
Excipient
Sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose, c'est-à-dire qu'il est essentiellement « sans sodium ».
INTERACTIONS |
Connectez-vous pour accéder à ce contenu
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Grossesse
Dans l'espèce humaine, aucune donnée ne montre que l'énoxaparine traverse la barrière placentaire pendant le deuxième et le troisième trimestre de la grossesse. Aucune information n'est disponible en ce qui concerne le premier trimestre.
Les études chez l'animal n'ont pas mis en évidence de fœtotoxicité ni de tératogénicité (voir rubrique Sécurité préclinique). Les données chez l'animal ont montré que le passage de l'énoxaparine à travers le placenta est minime.
L'énoxaparine sodique ne doit être utilisée pendant la grossesse que si le médecin en a clairement établi la nécessité.
Les femmes enceintes recevant de l'énoxaparine sodique doivent faire l'objet d'une surveillance étroite pour déceler tout signe de saignement ou d'anticoagulation excessive, et elles doivent être informées du risque d'hémorragie. Dans l'ensemble, les données suggèrent qu'il n'y a aucune preuve d'augmentation du risque d'hémorragie, de thrombopénie ou d'ostéoporose par rapport aux femmes qui ne sont pas enceintes, à l'exception des femmes enceintes porteuses de prothèses valvulaires cardiaques (voir rubrique Mises en garde et précautions d'emploi).
S'il est prévu de procéder à une anesthésie péridurale, il est recommandé d'arrêter le traitement par héparine avant (voir rubrique Mises en garde et précautions d'emploi).
Allaitement
Chez la femme, l'excrétion de l'énoxaparine sous forme inchangée dans le lait n'est pas connue. Chez les rates allaitantes, le passage de l'énoxaparine ou de ses métabolites dans le lait est très faible.
L'absorption orale d'énoxaparine sodique est peu probable. ENOXAPARINE TEVA peut être utilisé pendant l'allaitement.
Fertilité
Il n'existe aucune donnée clinique sur l'énoxaparine sodique relative à la fertilité. Les études chez l'animal n'ont montré aucun effet sur la fertilité (voir rubrique Sécurité préclinique).
CONDUITE et UTILISATION DE MACHINES |
L'énoxaparine sodique n'a aucun effet ou qu'un effet négligeable sur l'aptitude à conduire des véhicules et à utiliser des machines.
EFFETS INDÉSIRABLES |
Connectez-vous pour accéder à ce contenu
SURDOSAGE |
Signes et symptômes
Le surdosage accidentel après administration IV, extracorporelle ou SC d'énoxaparine sodique pourrait entraîner des complications hémorragiques. Suite à l'administration par voie orale de doses même massives, il est peu probable que l'énoxaparine sodique soit absorbée.
Prise en charge
Les effets anticoagulants peuvent être largement neutralisés par l'injection IV lente de protamine. La dose de protamine dépend de la dose d'énoxaparine sodique injectée :
Cependant, même à des doses élevées de protamine, l'activité anti-Xa de l'énoxaparine sodique n'est jamais complètement neutralisée (environ 60 % au maximum) (voir les informations de prescription pour les sels de protamine).
PHARMACODYNAMIE |
Connectez-vous pour accéder à ce contenu
PHARMACOCINÉTIQUE |
Connectez-vous pour accéder à ce contenu
SÉCURITÉ PRÉCLINIQUE |
En plus de l'effet anticoagulant de l'énoxaparine sodique, il n'a été démontré aucune preuve d'effets indésirables à la dose de 15 mg/kg/j administrée par voie SC pendant 13 semaines dans les études de toxicité conduites chez le rat et le chien et à la dose de 10 mg/kg/j SC et IV pendant 26 semaines dans les études de toxicité conduites chez le rat et le singe.
Dans les tests in vitro, incluant le test d'Ames, le test de mutation directe des lymphomes chez la souris, l'énoxaparine sodique n'a montré aucune activité mutagène. Dans les tests d'aberration chromosomique in vitro sur des lymphocytes humains et le test d'aberration chromosomique in vivo sur de la moelle osseuse de rat, l'énoxaparine sodique n'a montré aucune activité clastogène.
Aucune preuve d'effet tératogène ou de foetotoxicité n'a été montrée lors des études conduites chez les rates et les lapines gravides, recevant des doses d'énoxaparine SC jusqu'à 30 mg/kg/j. Il a été découvert que l'énoxaparine sodique n'avait aucun effet sur la fertilité ou la performance de reproduction des rats mâles et femelles à des doses SC allant jusqu'à 20 mg/kg/jour.
INCOMPATIBILITÉS |
En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé avec d'autres médicaments.
Injection par voie SC
Ne pas mélanger avec d'autres produits.
Injection par voie IV (bolus) (uniquement pour l'indication STEMI aigu) :
L'énoxaparine sodique peut être administrée en toute sécurité avec une solution saline normale (0,9 %) ou du glucose à 5 % dans de l'eau (voir rubrique Posologie et mode d'administration).
DURÉE DE CONSERVATION |
3 ans
PRÉCAUTIONS PARTICULIÈRES DE CONSERVATION |
A conserver à une température ne dépassant pas 25 °C.
Ne pas congeler.
Ce médicament est à usage unique. Jeter tout produit non utilisé.
PRÉCAUTIONS PARTICULIÈRES D'ÉLIMINATION ET DE MANIPULATION |
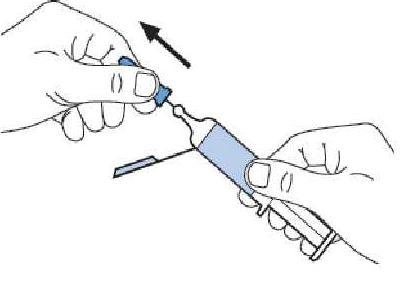
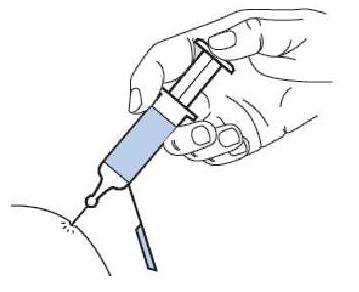
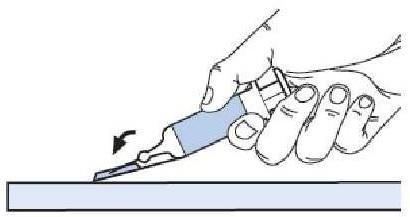
MODE D'EMPLOI : SERINGUE PREREMPLIE
L'utilisation appropriée de seringues est nécessaire pour réduire le risque de douleur et l'apparition d'ecchymoses au site d'injection. Veillez à suivre les instructions.
Instructions pour les seringues sans système de sécurité
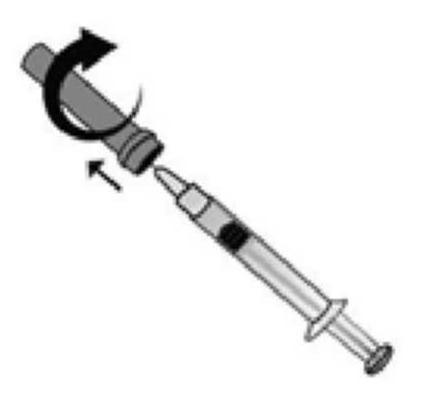
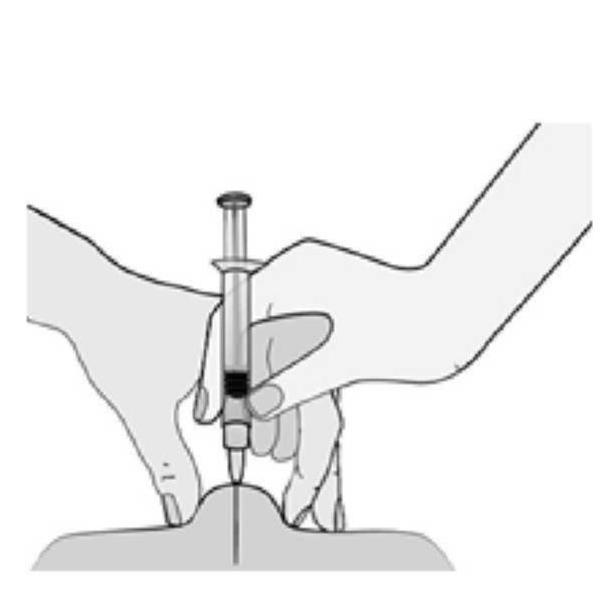 |
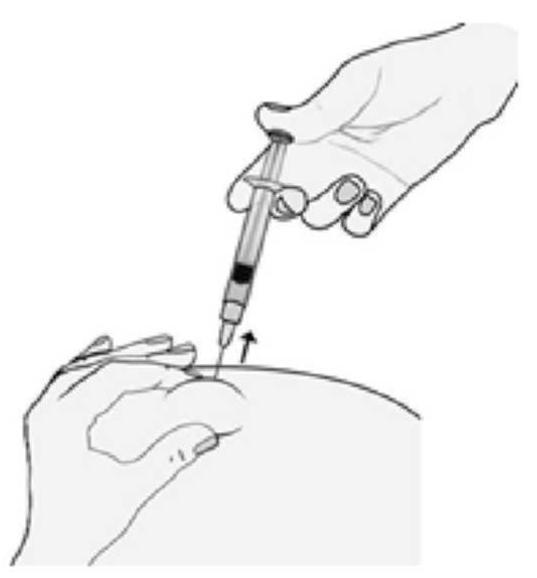 |
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Instructions pour les seringues avec système de sécurité
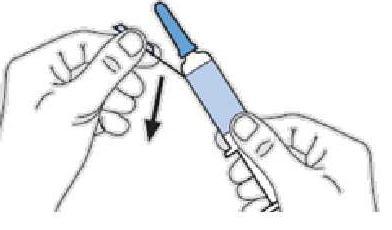
 |
 |
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| AMM |
|
| Prix : |
|
Remb Séc soc à 65 %. Collect.
Non remb Séc soc et non agréé Collect dans l'indication « traitement prolongé de la thrombose veineuse profonde (TVP) et de l'embolie pulmonaire (EP) et prévention de leur(s) récidive(s) chez les patients atteints d'un cancer actif ».