Veuillez saisir au moins 3 caractères pour votre recherche.
- Médicaments
- EPIDYOLEX
- EPIDYOLEX 100 mg/ml sol buv
Mise à jour : 22 août 2024
Sommaire
SYNTHÈSE |
aromatisant : fraise arôme
EEN sans dose seuil : sésame huile raffinée, éthanol anhydre, alcool benzylique
Cip : 3400930187968
Modalités de conservation : Avant ouverture : durant 24 mois
Après ouverture : durant 12 semaines
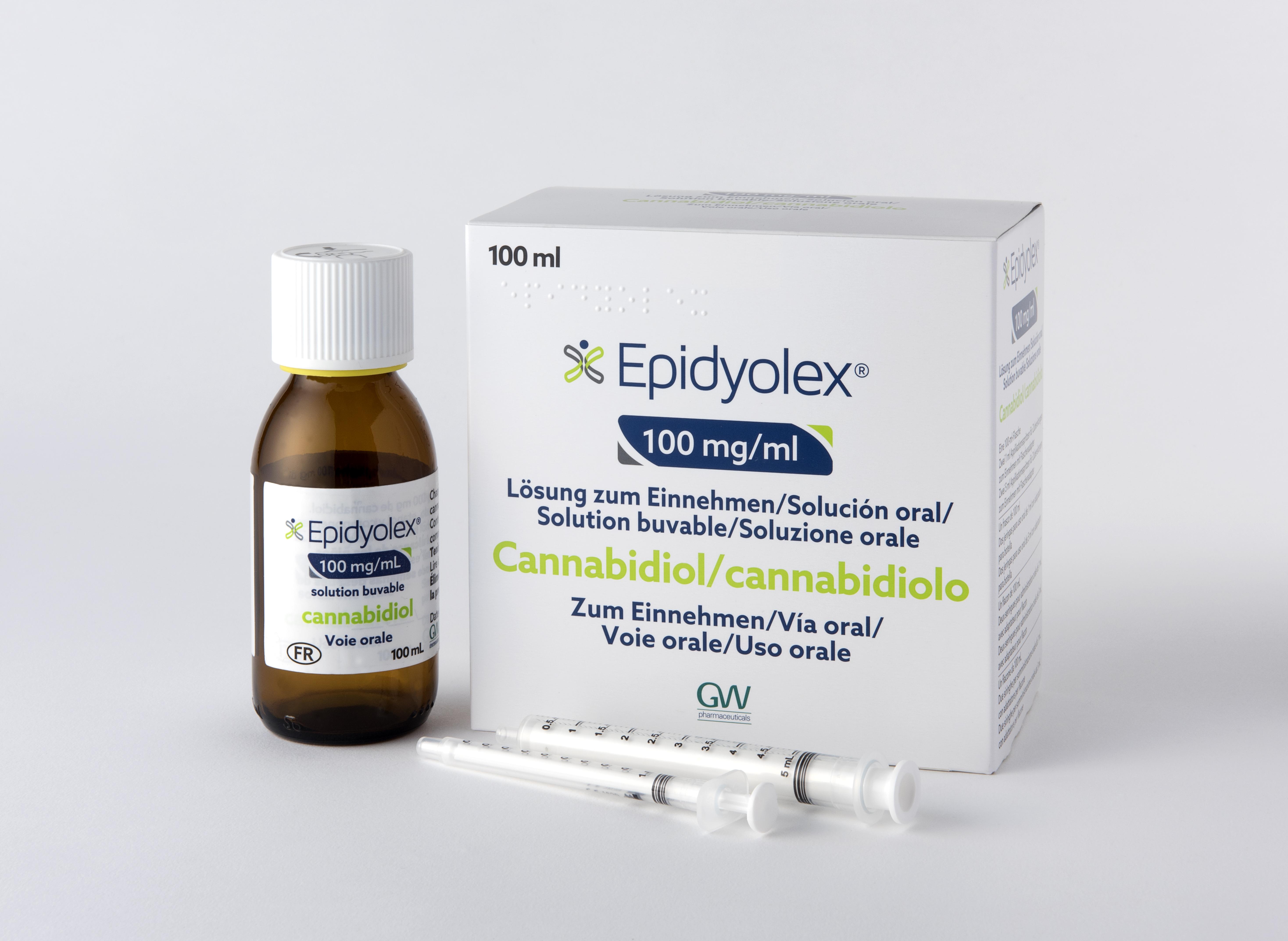
FORMES et PRÉSENTATIONS |
Solution buvable (limpide, incolore à jaune) .
Boîte de 1 flacon de 100 mL (avec bouchon à vis inviolable muni d'une sécurité enfant) + 2 seringues pour administration par voie orale de 5 mL et 2 seringues pour administration par voie orale de 1 mL + 2 adaptateurs de flacon.
Les seringues de 5 mL sont graduées par paliers de 0,1 mL et les seringues de 1 mL, par paliers de 0,05 mL.
COMPOSITION |
Chaque millilitre de solution buvable contient 100 mg de cannabidiol.
Excipients à effet notoire :
1 mL de solution contient : 79 mg d'éthanol anhydre, 736 mg d'huile de sésame raffinée, 0,0003 mg d'alcool benzylique.
Huile de sésame raffinée, éthanol anhydre, sucralose, arôme fraise (comprend de l'alcool benzylique).
INDICATIONS |
Epidyolex est indiqué, en association au clobazam, dans le traitement adjuvant des crises d'épilepsie associées au syndrome de Lennox-Gastaut (SLG) ou au syndrome de Dravet (SD), chez les patients de 2 ans et plus.
Epidyolex est indiqué dans le traitement adjuvant des crises d'épilepsie associées à une sclérose tubéreuse de Bourneville (STB) chez les patients de 2 ans et plus.
POSOLOGIE ET MODE D'ADMINISTRATION |
Connectez-vous pour accéder à ce contenu
CONTRE-INDICATIONS |
Connectez-vous pour accéder à ce contenu
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
Atteinte hépatocellulaire
Le cannabidiol peut entraîner des élévations dose-dépendantes des transaminases hépatiques (alanine aminotransférase [ALAT] et/ou aspartate aminotransférase [ASAT]) (voir rubrique Effets indésirables). Les élévations surviennent généralement dans les deux mois suivant l'instauration du traitement ; cependant, des cas ont été observés jusqu'à 18 mois après l'instauration du traitement, en particulier chez les patients prenant un traitement associé par valproate.
Dans les essais cliniques, la plupart des élévations de l'ALAT survenait chez les patients prenant un traitement associé par valproate. L'utilisation concomitante de clobazam a également augmenté l'incidence des élévations des transaminases, bien que dans une moindre mesure que le valproate. L'adaptation de la dose de valproate ou l'arrêt du traitement ou l'adaptation de la dose de clobazam doit être envisagé(e) en cas d'augmentation des transaminases.
Les élévations des transaminases ont été résolues avec l'interruption de cannabidiol ou la réduction de la dose de cannabidiol et/ou du valproate associé, dans environ deux tiers des cas. Dans environ un tiers des cas, les élévations des transaminases ont été résolues pendant le traitement par cannabidiol, sans réduction de la dose.
Les patients avec des taux de transaminases initiaux supérieurs à la LSN présentaient une incidence plus élevée d'élévations des transaminases pendant le traitement par cannabidiol. Chez certains patients, un effet synergique du traitement concomitant par valproate sur les transaminases initiales déjà élevées a entraîné un risque majoré d'élévations des transaminases.
Dans une étude non contrôlée menée dans une indication autre que l'épilepsie, deux patients âgés ont développé des élévations des taux de phosphatase alcaline supérieures à deux fois la LSN ainsi que des élévations des transaminases. Les élévations ont été résolues après l'interruption du traitement par cannabidiol.
Surveillance
En règle générale, les élévations des transaminases supérieures à trois fois la LSN en présence d'une bilirubine augmentée sans autre explication représentent un facteur prédictif important d'atteinte hépatique sévère. L'identification précoce des élévations des transaminases peut réduire le risque d'événement indésirable grave. Les patients avec des taux de transaminases initiaux supérieurs à trois fois la LSN ou des élévations de la bilirubine supérieures à deux fois la LSN doivent être évalués avant l'instauration du traitement par cannabidiol.
Avant l'instauration du traitement par cannabidiol, les taux sériques de transaminases (ALAT et ASAT) et de bilirubine totale doivent être contrôlés.
Surveillance systématique :
Les taux sériques de transaminases et de bilirubine totale doivent être contrôlés 1 mois, 3 mois et 6 mois après l'instauration du traitement par cannabidiol, et périodiquement par la suite ou selon l'indication clinique.
En cas de modification de la dose de cannabidiol supérieure à 10 mg/kg/jour ou tout changement au niveau des médicaments associés (modification de la dose ou ajout d'un autre traitement) susceptibles d'avoir un impact sur le foie, ce programme de surveillance devra être réinitié.
Surveillance intensifiée :
Les patients présentant des élévations initiales de l'ALAT ou de l'ASAT et les patients qui prennent du valproate doivent faire l'objet d'un dosage des taux sériques de transaminases et de bilirubine totale à 2 semaines, 1 mois, 2 mois, 3 mois et 6 mois après l'instauration du traitement par cannabidiol, et régulièrement par la suite ou selon l'indication clinique. En cas de modification de la dose de cannabidiol supérieure à 10 mg/kg/jour ou tout changement au niveau des médicaments associés (modification de la dose ou ajout d'un autre traitement) susceptibles d'avoir un impact sur le foie, ce programme de surveillance devra être réinitié.
Si un patient développe des signes ou des symptômes cliniques évoquant une atteinte hépatique, les taux sériques de transaminases et de bilirubine totale doivent être mesurés rapidement et le traitement par cannabidiol suspendu ou interrompu définitivement, au besoin. Le traitement par cannabidiol doit être interrompu chez les patients présentant des élévations des taux de transaminases supérieures à 3 fois la LSN et des taux de bilirubine supérieures à 2 fois la LSN. Il doit également être interrompu chez les patients présentant des élévations prolongées des transaminases supérieures à 5 fois la LSN. Les autres causes possibles doivent être explorées chez les patients présentant des élévations prolongées des transaminases sériques. Une adaptation de la dose des médicaments associés susceptibles d'avoir un impact sur le foie doit être envisagée (par ex. valproate et clobazam) (voir rubrique Interactions).
Somnolence et sédation
Le cannabidiol peut provoquer somnolence et sédation, qui apparaissent le plus souvent en début de traitement et peuvent se dissiper à la poursuite du traitement. L'incidence était plus élevée chez les patients prenant du clobazam en traitement concomitant (voir rubriques Interactions et Effets indésirables). Les autres dépresseurs du SNC, y compris l'alcool, peuvent potentialiser l'effet de somnolence et de sédation.
Augmentation de la fréquence des crises d'épilepsie
À l'instar des autres AE, une augmentation cliniquement significative de la fréquence des crises d'épilepsie peut apparaître pendant le traitement par cannabidiol ; cela peut nécessiter un ajustement de la dose de cannabidiol et/ou des AE associés, ou l'interruption du traitement par cannabidiol dans l'éventualité où le rapport bénéfice/risque serait négatif. Dans les essais cliniques de phase 3 menés dans le SLG, le SD et la STB, la fréquence observée d'états de mal épileptique était similaire entre les groupes cannabidiol et placebo.
Comportements et idées suicidaires
Des comportements et des idées suicidaires ont été rapportés chez les patients sous traitement AE dans plusieurs indications. Une méta-analyse d'essais randomisés contrôlés versus placebo avec des antiépileptiques a montré une légère augmentation du risque de comportements et d'idées suicidaires. Le mécanisme de ce risque n'est pas connu et les données disponibles n'excluent pas la possibilité d'un risque accru pour le cannabidiol.
Les patients doivent être surveillés en vue de déceler d'éventuels signes de comportements et d'idées suicidaires et un traitement approprié doit être envisagé. Les patients et les soignants des patients doivent être invités à consulter un médecin si des signes de comportements et d'idées suicidaires venaient à apparaître.
Perte de poids
Le cannabidiol peut provoquer une perte de poids ou une diminution de la prise de poids (voir rubrique Effets indésirables). Chez les patients atteints du SLG, du SD et de la STB, ce phénomène pourrait être lié à la dose. Dans certains cas, la perte de poids a été rapportée comme un événement indésirable (voir tableau 3). La baisse de l'appétit et la perte de poids peuvent légèrement ralentir la croissance. Une perte de poids ou une absence de prise de poids continue doit faire l'objet d'une surveillance régulière pour déterminer si le traitement par cannabidiol doit être interrompu.
Huile de sésame contenue dans la solution
Ce médicament contient de l'huile de sésame raffinée qui peut, dans de rares cas, provoquer des réactions allergiques sévères.
Alcool benzylique contenu dans la solution
Ce médicament contient 0,0003 mg/ml d'alcool benzylique, correspondant à 0,0026 mg par dose maximale d'Epidyolex (Epidyolex 12,5 mg/kg par dose (STB) chez un adulte pesant 70 kg). L'alcool benzylique peut provoquer des réactions allergiques.
Populations non étudiées
Les patients présentant une insuffisance cardiovasculaire cliniquement significative n'ont pas été inclus dans le programme de développement clinique de la STB.
INTERACTIONS |
Connectez-vous pour accéder à ce contenu
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Grossesse
Il existe des données limitées sur l'utilisation du cannabidiol chez la femme enceinte. Les études effectuées chez l'animal ont mis en évidence une toxicité sur la reproduction (voir rubrique Sécurité préclinique).
Par mesure de précaution, il est préférable d'éviter l'utilisation du cannabidiol pendant la grossesse sauf si le bénéfice potentiel pour la mère l'emporte nettement sur le risque potentiel pour le fœtus.
Allaitement
Il n'existe pas de données cliniques sur la présence de cannabidiol ou ses métabolites dans le lait maternel, les effets sur l'enfant allaité ou les effets sur la production de lait.
Les études réalisées sur des animaux ont mis en évidence des modifications toxicologiques chez les femelles allaitantes lorsque la mère était traitée avec du cannabidiol (voir rubrique Sécurité préclinique).
Aucune étude sur le passage du cannabidiol dans le lait maternel n'a été menée chez l'humain. Le cannabidiol étant fortement lié aux protéines et susceptible de passer librement du plasma dans le lait, l'allaitement doit être suspendu pendant le traitement par mesure de précaution.
Fertilité
Aucune donnée sur l'effet du cannabidiol sur la fertilité humaine n'est disponible.
Aucun effet sur la capacité de reproduction des rats mâles ou femelles n'a été observé avec une dose par voie orale allant jusqu'à 150 mg/kg/jour de cannabidiol (voir rubrique Sécurité préclinique).
CONDUITE et UTILISATION DE MACHINES |
Le cannabidiol a une influence majeure sur l'aptitude à conduire des véhicules et à utiliser des machines car il peut provoquer somnolence et sédation (voir rubrique Mises en garde et précautions d'emploi). Il est recommandé aux patients de ne pas conduire de véhicules ni utiliser de machines tant qu'ils n'ont pas acquis suffisamment d'expérience avec le cannabidiol pour pouvoir estimer son influence sur leurs capacités (voir rubrique Effets indésirables).
EFFETS INDÉSIRABLES |
Connectez-vous pour accéder à ce contenu
SURDOSAGE |
Symptômes
L'expérience avec des doses supérieures à la dose thérapeutique recommandée est limitée. Des diarrhées et des épisodes de somnolence légers ont été rapportés chez des adultes en bonne santé prenant une dose unique de 6 000 mg, ce qui correspond à une dose supérieure à 85 mg/kg pour un adulte de 70 kg. Ces effets indésirables ont été résolus après la fin de l'étude.
Prise en charge du surdosage
En cas de surdosage, le patient doit être placé en observation et recevoir un traitement symptomatique approprié, notamment une surveillance des constantes vitales.
PHARMACODYNAMIE |
Connectez-vous pour accéder à ce contenu
PHARMACOCINÉTIQUE |
Connectez-vous pour accéder à ce contenu
SÉCURITÉ PRÉCLINIQUE |
Mutagénicité et carcinogénicité
Dans une étude de carcinogénicité menée sur des souris, l'administration par voie orale d'Epidyolex (0 [eau], 0 [véhicule], 30, 100 ou 300 mg/kg/jour) pendant 2 ans a augmenté l'incidence des adénomes hépatocellulaires bénins chez les souris mâles à toutes les doses testées et chez les souris femelles à la plus forte dose testée. À la plus forte dose étudiée, les expositions plasmatiques (ASC) chez les souris étaient environ 7 fois supérieures à l'exposition anticipée chez l'humain à une dose de 25 mg/kg/jour.
Aucune étude du potentiel carcinogène du cannabidiol chez les rats n'a été menée.
Les études de génotoxicité n'ont pas mis en évidence d'activité mutagène ou clastogène.
Toxicité de la reproduction et du développement
Aucun effet indésirable n'a été observé sur la fertilité ou la reproduction des rats mâles et femelles jusqu'à la dose de 250 mg/kg/jour (environ 34 fois la dose humaine maximale recommandée de 25 mg/kg/jour).
Une étude sur le développement embryo-fœtal menée sur des lapins a évalué des doses de 50, 80 ou 125 mg/kg/jour. La dose de 125 mg/kg/jour a entraîné une réduction du poids fœtal et une augmentation des variations structurelles fœtales associées à une toxicité maternelle. Les expositions plasmatiques maternelles au cannabidiol à la dose sans effet toxique sur la toxicité développementale embryo-fœtale chez les lapins étaient inférieures à celles de l'homme à une dose de 25 mg/kg/jour.
L'étude de développement embryo-fœtal chez les rats a évalué des doses de 75, 150 ou 250 mg/kg/jour. Une mortalité embryo-fœtale a été observée avec la dose élevée, sans effets liés au traitement sur la perte post-implantation avec les doses faibles ou intermédiaires. La dose sans effet toxique était associée à des expositions plasmatiques maternelles environ 9 fois supérieures à l'exposition anticipée chez l'homme à une dose de 25 mg/kg/jour.
Une étude de développement prénatal et postnatal a été menée sur des rats à des doses de 75, 150 ou 250 mg/kg/jour. Une croissance ralentie, une maturation sexuelle retardée, des changements comportementaux (baisse d'activité) et des effets indésirables sur le développement des organes reproducteurs mâles (testicules de petite taille chez la progéniture adulte) et la fertilité mâle ont été observés chez la progéniture à des doses ≥ 150 mg/kg/jour. La dose sans effet toxique était associée à des expositions plasmatiques maternelles au cannabidiol environ 5 fois supérieures à celles de l'homme à une dose de 25 mg/kg/jour.
Toxicité juvénile
Chez les rats juvéniles, l'administration de cannabidiol pendant 10 semaines (doses sous-cutanées de 0 ou 15 mg/kg les jours postnataux [JPN] 4-6, suivies d'une administration par voie orale de 0, 100, 150 ou 250 mg/kg les JPN 7-77) a provoqué une augmentation du poids corporel, une maturation sexuelle retardée chez les mâles, des effets neuro-comportementaux, une augmentation de la densité minérale osseuse et une vacuolisation des hépatocytes. Aucune dose sans effet n'a été établie. La dose la plus faible entraînant une toxicité développementale chez les rats juvéniles (15 mg/kg par voie sous-cutanée/100 mg/kg par voie orale) était associée à des expositions au cannabidiol (ASC) environ 8 fois supérieure à celle de l'homme à 25 mg/kg/jour.
Dans une autre étude, le cannabidiol était administré à des rats juvéniles les JPN 4-21 (en injection sous-cutanée) et les JPN 22-50 (en injection intraveineuse). Une dose sans effet toxique de 15 mg/kg/jour a été établie.
Potentiel d'abus
Les études animales menées pour identifier un potentiel d'abus médicamenteux montrent que le cannabidiol ne provoque pas de réponses comportementales analogues à celles des cannabinoïdes, notamment la généralisation au delta-9-tétrahydrocannabinol (THC) dans une étude de discrimination. Le cannabidiol n'entraîne pas non plus d'auto-administration de la part de l'animal, ce qui suggère qu'il ne provoque pas d'effets addictifs.
DURÉE DE CONSERVATION |
2 ans.
Utiliser dans les 12 semaines suivant la première ouverture du flacon.
PRÉCAUTIONS PARTICULIÈRES DE CONSERVATION |
Ce médicament ne nécessite pas de précautions particulières de conservation.
PRÉCAUTIONS PARTICULIÈRES D'ÉLIMINATION ET DE MANIPULATION |
Les sondes nasogastriques en silicone d'une longueur de plus de 50 cm et maximale de 125 cm, et d'un diamètre de plus de 5 FR et maximal de 12 FR, peuvent être utilisées. Les sondes nasogastriques en silicone de 50 cm de long ou plus courtes et d'un diamètre de 5 FR ou moins doivent être évitées. Les sondes gastriques en silicone d'une longueur de 0,8 à 4 cm et d'un diamètre de 12 FR à 24 FR, peuvent être utilisées. Les sondes en polychlorure de vinyle et polyuréthane ne doivent pas être utilisées.
Après l'administration, la sonde d'administration entérale doit être rincée au moins une fois avec de l'eau à température ambiante. Si plusieurs médicaments sont administrés, la sonde doit être rincée entre chaque médicament. Il est recommandé d'utiliser un volume de rinçage d'environ 5 fois le volume d'amorçage de la sonde (avec un minimum de 3 ml pour les sondes les plus courtes/étroites jusqu'à un maximum de 20 ml pour les sondes les plus longues/larges). Le volume de rinçage peut être modifié chez les patients nécessitant une administration restreinte de liquides.
Les sondes entérales avec connecteurs ENFit® requièrent l'utilisation de seringues compatibles avec ENFit ainsi que d'adaptateurs pour flacon. Pour optimiser la précision de la dose, des seringues de 1 ml doivent être utilisées pour les doses ≤ 1 ml.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| AMM |
|
| Prix : |
|