Veuillez saisir au moins 3 caractères pour votre recherche.
- Médicaments
- FASLODEX
- FASLODEX 250 mg sol inj
Mise à jour : 10 février 2023
Sommaire
SYNTHÈSE |
EEN sans dose seuil : éthanol à 96 %, alcool benzylique, benzoate de benzyle, ricin huile raffinée
Cip : 3400936349001
Modalités de conservation : Avant ouverture : 2° < t < 8° durant 4 ans (Conserver à l'abri de la lumière, Conserver dans son emballage, Conserver au réfrigérateur)
FORMES et PRÉSENTATIONS |
COMPOSITION |
| p seringue | |
| Fulvestrant (DCI) | 250 mg |
Excipients à effet notoire (pour 5 ml) : éthanol (96 %, 500 mg), alcool benzylique (500 mg), benzoate de benzyle (750 mg).
INDICATIONS |
POSOLOGIE ET MODE D'ADMINISTRATION |
Connectez-vous pour accéder à ce contenu
CONTRE-INDICATIONS |
Connectez-vous pour accéder à ce contenu
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
INTERACTIONS |
Connectez-vous pour accéder à ce contenu
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Les patientes en âge de procréer doivent utiliser une contraception efficace pendant le traitement par Faslodex et pendant 2 ans après avoir reçu la dernière dose.
Faslodex est contre-indiqué lors de la grossesse (cf Contre-indications). Le fulvestrant traverse le placenta après une injection intramusculaire unique chez la rate et la lapine. Des études chez l'animal ont montré une toxicité sur les fonctions de reproduction, y compris une augmentation de l'incidence des anomalies et des morts fœtales (cf Sécurité préclinique). En cas de grossesse survenant lors du traitement par Faslodex, la patiente devra être avertie du risque potentiel pour le fœtus et du risque potentiel de fausse couche.
L'allaitement doit être interrompu pendant le traitement par Faslodex. Le fulvestrant est excrété dans le lait de rates qui allaitent. Il n'y a pas de données sur l'excrétion du fulvestrant dans le lait maternel. Compte tenu du risque potentiel d'effets indésirables sévères du fulvestrant pour le nourrisson allaité, l'utilisation pendant l'allaitement est contre-indiquée (cf Contre-indications).
Fertilité :Les effets de Faslodex sur la fertilité dans l'espèce humaine n'ont pas été étudiés.
CONDUITE et UTILISATION DE MACHINES |
EFFETS INDÉSIRABLES |
Connectez-vous pour accéder à ce contenu
SURDOSAGE |
Des cas isolés de surdosage ont été rapportés avec Faslodex chez l'humain. En cas de surdosage, un traitement symptomatique est recommandé. Au cours des études chez l'animal, aucun effet autre que ceux liés directement ou indirectement à l'activité anti-estrogène n'a été mis en évidence à des doses plus élevées de fulvestrant (cf Sécurité préclinique).
PHARMACODYNAMIE |
Connectez-vous pour accéder à ce contenu
PHARMACOCINÉTIQUE |
Connectez-vous pour accéder à ce contenu
SÉCURITÉ PRÉCLINIQUE |
La toxicité aiguë du fulvestrant est faible.
Faslodex, comme les autres formulations de fulvestrant, a été bien toléré dans les espèces animales étudiées lors des études à doses multiples. Des réactions locales au site d'injection, incluant myosite et granulome, ont été attribuées aux excipients, mais la sévérité de la myosite chez le lapin a été plus importante dans le groupe fulvestrant que dans le groupe contrôle (solution saline).
Lors des études de toxicité par administration intramusculaire réitérée menées chez le rat et le chien, la plupart des effets observés, particulièrement les effets sur les organes reproducteurs femelles mais aussi sur les organes hormono-sensibles des deux sexes, ont pu être attribués à l'activité antiestrogénique du fulvestrant. Une artérite au niveau de différents tissus a été observée chez plusieurs chiens après une administration chronique (12 mois).
Dans des études chez des chiens, après administration orale ou intraveineuse, des effets sur le système cardiovasculaire ont été observés : léger allongement du segment S-T de l'électrocardiogramme (voie orale) et pause sinusale chez un chien (voie intraveineuse). Ces effets sont apparus pour des expositions supérieures à celles utilisées chez des patientes (Cmax > 15 fois) et sont considérés comme peu significatifs en matière de sécurité d'emploi pour l'espèce humaine aux doses cliniques.
Le fulvestrant n'a montré aucun potentiel génotoxique.
Les effets constatés, à des doses similaires aux doses cliniques, sur la reproduction et sur le développement embryonnaire et fœtal sont la conséquence de l'activité antiestrogène du fulvestrant.
Chez les rats, une diminution réversible de la fertilité des femelles, une diminution de la survie embryonnaire, une dystocie et une augmentation de la fréquence des anomalies fœtales y compris de la courbure du tarse ont été observées. Chez des lapines ayant reçu du fulvestrant, la gestation n'a pu être maintenue. Une augmentation du poids du placenta et des pertes postimplantatoires ont été observés. Chez les lapines, il y a eu une augmentation de l'incidence des modifications fœtales (bascule en arrière du bassin et de la vertèbre présacrée 27).
Une étude de cancérogénicité de deux ans chez les rats (administration intramusculaire de Faslodex) a mis en évidence une augmentation de la fréquence des tumeurs ovariennes bénignes des cellules de la granulosa chez les rats femelles pour de fortes doses de 10 mg/rat/15 jours, et une augmentation des tumeurs des cellules testiculaires de Leydig chez les mâles. Lors d'une étude de cancérogénicité de deux ans chez la souris (administration orale quotidienne), il y a eu une augmentation de l'incidence des tumeurs du stroma et des cordons sexuels de l'ovaire (à la fois bénignes et malignes) à des doses de 150 et 500 mg/kg/jour. A la dose sans effet pour ces événements, les niveaux d'exposition systémique (ASC) étaient, chez les rats, approximativement 1,5 fois les niveaux d'exposition attendus chez la femme et 0,8 fois chez l'homme et, chez les souris, approximativement 0,8 fois les niveaux d'exposition attendus à la fois chez l'homme et chez la femme. L'induction de telles tumeurs est cohérente avec les modifications pharmacologiques endocriniennes des taux de gonadotropine provoquées par les anti-estrogènes chez des animaux en activité hormonale. De ce fait, ces résultats ne sont pas considérés comme significatifs dans le cadre de l'utilisation du fulvestrant chez des femmes ménopausées souffrant d'un cancer du sein au stade avancé.
INCOMPATIBILITÉS |
En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé avec d'autres médicaments.
MODALITÉS DE CONSERVATION |
Durée de conservation : 4 ans.
A conserver et à transporter au réfrigérateur (entre 2 °C et 8 °C).
Les excursions de température en dehors de 2 °C - 8 °C doivent être limitées. La conservation à des températures supérieures à 30 °C est exclue, et la durée de conservation à une température moyenne pour le produit inférieure à 25 °C (mais supérieure à 2 °C-8 °C) ne doit pas excéder 28 jours. Après des excursions de température, le produit doit être replacé immédiatement dans les conditions de conservation recommandées (à conserver et à transporter au réfrigérateur entre 2 °C et 8 °C). Les excursions de température ont un effet cumulatif sur la qualité du produit et la durée de 28 jours ne doit pas être dépassée au cours de la durée de conservation de 4 ans de Faslodex. Une exposition à des températures inférieures à 2 °C n'endommagera pas le produit sous réserve de ne pas le stocker en dessous de - 20 °C.
Conserver la seringue préremplie dans l'emballage d'origine pour la protéger de la lumière.
MODALITÉS MANIPULATION/ÉLIMINATION |
| Figure 1 |
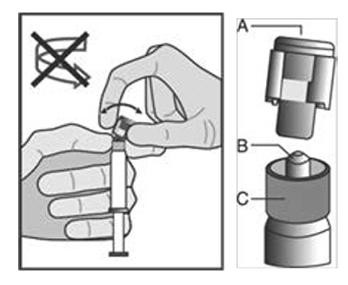 |
| Figure 2 |
 |
| Figure 3 |
 |
| Figure 4 |
 |
| Figure 5 |
 |
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| AMM | EU/1/03/269/001 ; CIP 3400936349001 (2004, RCP rév 02.04.2020). |
| Prix : | 184,67 euros (1 seringue). |
| Remb Séc soc à 100 % sur la base du TFR : 92,89 euros (1 seringue) et Collect dans l'indication : « En monothérapie dans le traitement du cancer du sein localement avancé ou métastatique, positif pour les récepteurs aux estrogènes, chez les femmes ménopausées avec une récidive pendant ou après un traitement adjuvant par un anti-estrogène ou une progression de la maladie sous traitement par anti-estrogène ». | |
| Dans les autres indications : demandes à l'étude à la date du 02.01.2023. | |
Titulaire de l'AMM : AstraZeneca AB, SE-151 85 Södertälje, Suède.
