Veuillez saisir au moins 3 caractères pour votre recherche.
- Médicaments
- FLUENZ TETRA
- FLUENZ TETRA susp p pulv nasal Vaccin grippal (vivant atténué, nasal)
Mise à jour : 11 septembre 2023
Sommaire
SYNTHÈSE |
Cip : 3400927937668
Modalités de conservation : Avant ouverture : 2° < t < 8° durant 18 semaines (Conserver à l'abri de la lumière, Conserver dans son emballage, Conserver au réfrigérateur, Ne pas congeler)
FORMES et PRÉSENTATIONS |
COMPOSITION |
| Virus(a) grippal réassorti (vivant atténué) des quatre souches suivantes(b) : | par dose (0,2 ml) |
| A/Victoria/4897/2022 (H1N1) pdm09, souche analogue (A/Norway/31694/2022, MEDI 369815) | 107,0±0,5 UFF(c) |
| A/Darwin/9/2021 (H3N2), souche analogue (A/Norway/16606/2021, MEDI 355293) | 107,0±0,5 UFF(c) |
| B/Austria/1359417/2021, souche analogue (B/Austria/1359417/2021, MEDI 355292) | 107,0±0,5 UFF(c) |
| B/Phuket/3073/2013, souche analogue (B/Phuket/3073/2013, MEDI 306444) | 107,0±0,5 UFF(c) |
Ce vaccin est conforme à la recommandation de l'OMS (hémisphère Nord) et à la décision de l'UE pour la saison 2023/2024.
Le vaccin peut contenir des résidus des substances suivantes : protéines d'œuf (ex : ovalbumine) et gentamicine. La quantité maximale d'ovalbumine est inférieure à 0,024 microgrammes par dose de 0,2 ml (0,12 microgrammes par ml).
INDICATIONS |
POSOLOGIE ET MODE D'ADMINISTRATION |
Connectez-vous pour accéder à ce contenu
CONTRE-INDICATIONS |
Connectez-vous pour accéder à ce contenu
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
Traçabilité : afin d'améliorer la traçabilité des médicaments biologiques, le nom de marque ainsi que le numéro de lot du produit administré doivent être clairement enregistrés.
Comme pour la plupart des vaccins, il est recommandé de toujours disposer d'un traitement médical approprié et d'assurer une surveillance, afin de prendre en charge une réaction anaphylactique ou d'hypersensibilité grave suite à l'administration de Fluenz Tetra.
Fluenz Tetra ne doit pas être administré aux enfants et adolescents présentant un asthme sévère ou une respiration sifflante en cours, ce type de patient n'ayant pas fait l'objet d'études cliniques adaptées.
Il convient d'informer les personnes vaccinées que Fluenz Tetra est un vaccin constitué d'un virus vivant atténué susceptible d'être transmis à des sujets immunodéprimés. Il est conseillé aux personnes vaccinées d'éviter, autant que possible, le contact étroit avec des sujets sévèrement immunodéprimés (ex : bénéficiaires d'une greffe de moelle osseuse nécessitant un isolement) pendant 1 à 2 semaines suivant la vaccination. Les études cliniques avec Fluenz indiquent un pic d'incidence de présence du virus vaccinal 2 à 3 jours après la vaccination. Dans les situations où le contact avec des patients sévèrement immunodéprimés ne peut être évité, le risque potentiel de transmission du virus vaccinal de la grippe doit être mis en balance avec le risque de contracter et transmettre un virus de la grippe de type sauvage.
Fluenz Tetra ne doit en aucun cas être injecté.
Il n'existe pas de données concernant la tolérance de l'administration intranasale de Fluenz Tetra chez les enfants souffrant de malformations cranio-faciales non corrigées.
INTERACTIONS |
Connectez-vous pour accéder à ce contenu
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Il existe peu de données sur l'utilisation de Fluenz Tetra chez la femme enceinte. Les données chez 138 femmes enceintes pour lesquelles une administration de Fluenz vaccin trivalent était enregistrée dans une base de données américaine de compagnies d'assurance n'indiquent pas d'issues défavorables significatives pour la mère. Dans plus de 300 cas enregistrés dans la base de données de pharmacovigilance, rapportant une administration du vaccin chez la femme enceinte, aucune complication maternelle ou fœtale n'a été observée.
Bien que les études effectuées chez l'animal n'aient pas mis en évidence d'effets délétères directs ou indirects sur la reproduction et que les données post-commercialisation soient plutôt rassurantes en cas d'administration par inadvertance du vaccin, Fluenz Tetra n'est pas recommandé pendant la grossesse.
On ne sait pas si Fluenz Tetra est excrété dans le lait maternel. Par conséquent, sachant que certains virus sont excrétés dans le lait maternel, Fluenz Tetra ne doit pas être utilisé pendant l'allaitement.
Les données disponibles sont limitées. Celles-ci indiquent que Fluenz Tetra ne serait pas excrété dans le lait maternel.
Fertilité :Il n'existe aucune donnée sur les éventuels effets de Fluenz Tetra sur la fertilité masculine et féminine.
CONDUITE et UTILISATION DE MACHINES |
EFFETS INDÉSIRABLES |
Connectez-vous pour accéder à ce contenu
SURDOSAGE |
Un surdosage de Fluenz Tetra est peu probable en raison de sa présentation sous forme de pulvérisateur prérempli. L'administration d'une dose de Fluenz Tetra supérieure à la dose recommandée a rarement été signalée et le profil des effets indésirables était comparable à celui observé avec la dose recommandée de Fluenz Tetra.
PHARMACODYNAMIE |
Connectez-vous pour accéder à ce contenu
SÉCURITÉ PRÉCLINIQUE |
Les données non cliniques issues des études conventionnelles non cliniques de toxicologie en administration répétée, des fonctions de reproduction et de développement, de tolérance locale et de neurovirulence n'ont pas révélé de risque particulier pour l'homme.
INCOMPATIBILITÉS |
En l'absence d'études de compatibilité, ce vaccin ne doit pas être mélangé avec d'autres médicaments.
MODALITÉS DE CONSERVATION |
Durée de conservation : 18 semaines.
A conserver au réfrigérateur (entre 2 °C et 8 °C). Ne pas congeler.
Conserver l'applicateur nasal dans l'emballage extérieur à l'abri de la lumière.
Avant utilisation, le vaccin peut être sorti du réfrigérateur une fois pour une durée maximale de 12 heures à une température ne dépassant pas 25 °C.
Les données de stabilité indiquent que les composants du vaccin sont stables pendant 12 heures lorsqu'ils sont conservés à des températures de 8 °C à 25 °C. Passé ce délai, Fluenz Tetra doit être immédiatement utilisé ou éliminé.
MODALITÉS MANIPULATION/ÉLIMINATION |
 |
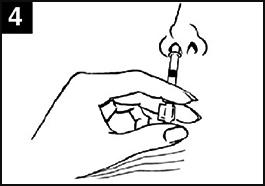
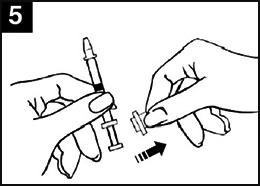
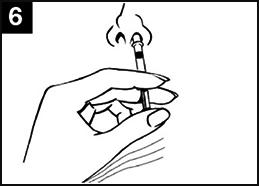
| Image 1 : Administration de Fluenz Tetra |
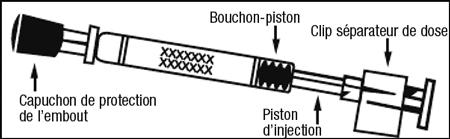 |
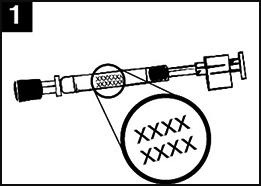 |
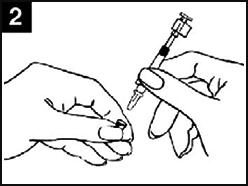 |
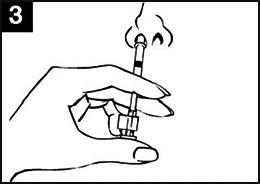 |
 |
 |
 |
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation relative aux déchets médicaux en vigueur.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| Médicament soumis à prescription médicale. | |
| AMM | EU/1/13/887/003 ; CIP 3400927937668 (2013, RCP rév 28.07.2023). |
| Collect. |
Titulaire de l'AMM : AstraZeneca AB, SE-151 85 Södertälje, Suède.
