Classification pharmacothérapeutique VIDAL
Urologie - Néphrologie > Médicaments de la lithiase urinaire (Alcalinisants urinaires)
Classification ATC
SYSTEME GENITO URINAIRE ET HORMONES SEXUELLES > MEDICAMENTS UROLOGIQUES > MEDICAMENTS UROLOGIQUES (SOLUBILISANTS DES CALCULS URINAIRES)
Excipients
saccharine sodique aromatisant : orange jus, orange douce essence, mandarine essence
Excipients à effet notoire :
EEN sans dose seuil : jaune orangé S, saccharose
EEN avec dose seuil : sodium, potassium
Présentation
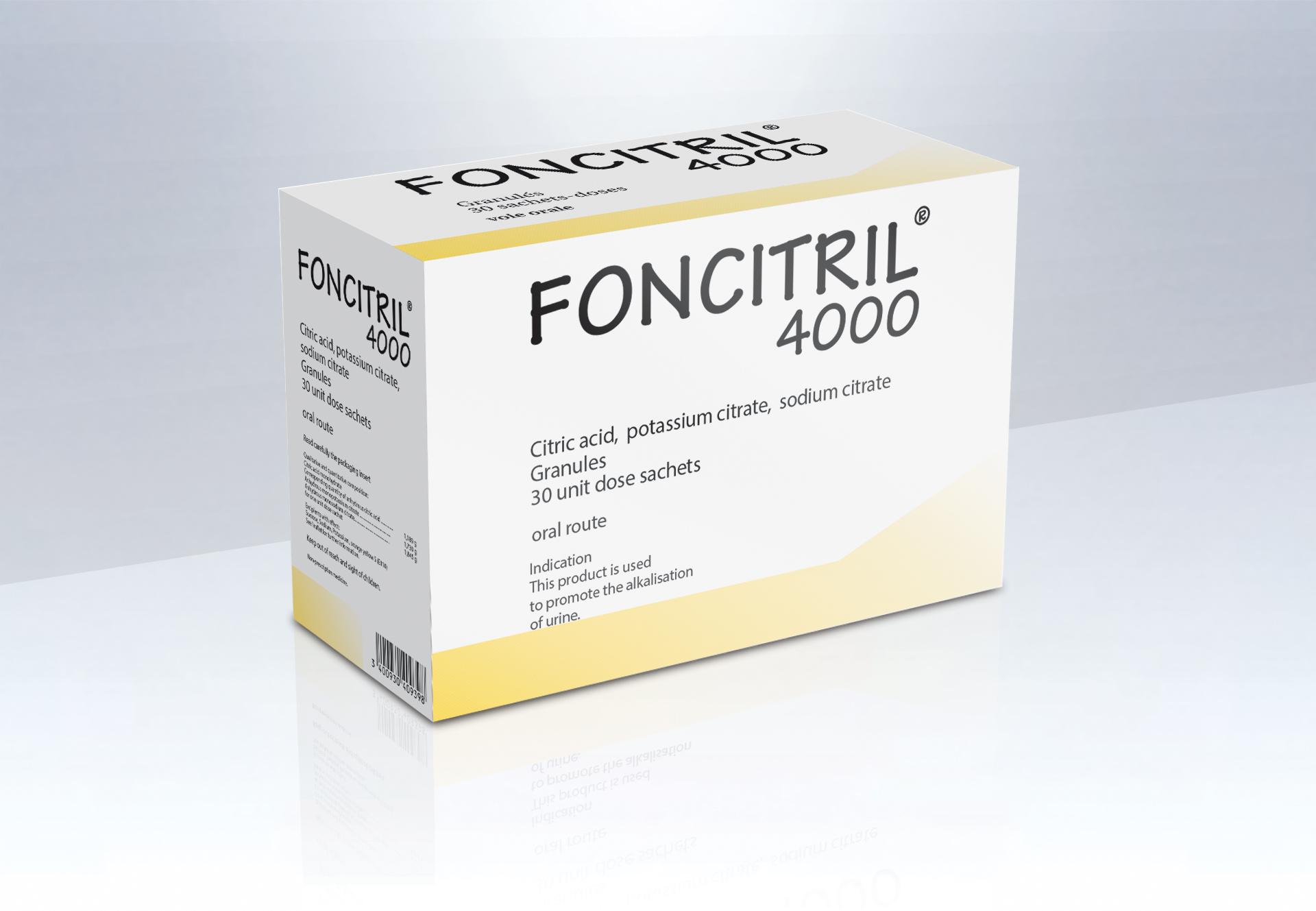
FONCITRIL 4000 Glé en sachet-dose 30Sach/10g
Cip : 3400930409398
Modalités de conservation : Avant ouverture : durant 36 mois
| | p sachet |
Acide citrique monohydraté exprimé en acide citrique anhydre
| 1,189 g |
Citrate monopotassique anhydre
| 1,73 g |
Citrate monosodique anhydre
| 1,845 g |
Excipients : saccharine sodique, jus d'orange concentré, huile essentielle d'orange douce, huile essentielle de mandarine, jaune orangé S (E 110), saccharose.
Excipients à effet notoire : saccharose (5,1 g/sachet), sodium (200,6 mg/sachet), potassium (293 mg/sachet), jaune orangé S (E 110).
- Favorise l'alcalinisation des urines dans le traitement et la prévention des lithiases uriques et cystiniques.
- Utilisé comme alcalinisant au cours des traitements uricosuriques et uricolytiques.
- Prévention de l'acidose métabolique.
POSOLOGIE ET MODE D'ADMINISTRATION |
Connectez-vous pour accéder à ce contenu
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
- Ce médicament contient du saccharose. Son utilisation est déconseillée chez les patients présentant une intolérance au fructose, un syndrome de malabsorption du glucose et du galactose ou un déficit en sucrase/isomaltase.
- Ce médicament contient 5,1 g de saccharose par sachet), dont il faut tenir compte dans la ration journalière en cas de régime pauvre en sucre ou de diabète.
- Ce médicament contient 200 mg de sodium par sachet, ce qui équivaut à 10 % de l'apport alimentaire quotidien maximal recommandé par l'OMS de 2 g de sodium par adulte.
- En traitement d'attaque, la dose journalière maximale de ce médicament équivaut à 40 % de l'apport alimentaire quotidien maximal recommandé par l'OMS de sodium.
- En traitement d'entretien, la dose journalière maximale de ce médicament équivaut à 20 % de l'apport alimentaire quotidien maximal recommandé par l'OMS de sodium.
- Foncitril 4000 est considéré comme élevé en sodium. A prendre en compte chez les patients suivant un régime hyposodé.
- Ce médicament contient 293 mg de potassium par sachet. A prendre en compte chez les patients insuffisants rénaux ou chez les patients suivant un régime hypokaliémiant.
- Ce médicament contient un agent azoïque (E110) et peut provoquer des réactions allergiques.
- Une diurèse abondante sera assurée pendant le traitement.
- Ce médicament nécessite une surveillance du pH urinaire (qui doit se maintenir entre 6,5 et 7,4) et de l'ionogramme sanguin.
- Des examens cytobactériologiques urinaires seront répétés.
- Une élévation du pH urinaire peut être obtenue par un régime pauvre en protides et riche en légumes à résidu alcalin, notamment les agrumes.
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Grossesse :
En clinique, aucun effet malformatif ou fœtotoxique particulier n'est apparu à ce jour. Toutefois, le suivi de grossesses exposées à ce médicament est insuffisant pour exclure tout risque.
En conséquence, l'utilisation de ce médicament ne doit être envisagée au cours de la grossesse que si nécessaire.
Allaitement :
En l'absence de données cinétiques, ce médicament ne doit pas être administré en cas d'allaitement.
CONDUITE et UTILISATION DE MACHINES |
Aucun effet sur l'aptitude à conduire des véhicules et à utiliser des machines n'a été observé.
Aucun cas de surdosage n'a été observé. Du fait de la présence de potassium, un suivi de la kaliémie et du rythme cardiaque est recommandé en cas d'ingestion massive.
MODALITÉS DE CONSERVATION |
-
Durée de conservation :
- 3 ans.
Pas de précautions particulières de conservation.
MODALITÉS MANIPULATION/ÉLIMINATION |
Pas d'exigences particulières pour l'élimination.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| AMM | 3400930409398 (1966/97, RCP rév 25.07.2018). |
Mis sur le marché en
1967.