Veuillez saisir au moins 3 caractères pour votre recherche.
- Médicaments
- GLYDO
- GLYDO 20 mg/ml gel en seringue préremplie
Mise à jour : 22 août 2024
Sommaire
SYNTHÈSE |
lidocaïne chlorhydrate monohydrate
Cip : 3400930246382
Modalités de conservation : Avant ouverture : durant 36 mois (Conserver à l'abri de la lumière, Conserver dans son emballage)
.jpg)
FORMES et PRÉSENTATIONS |
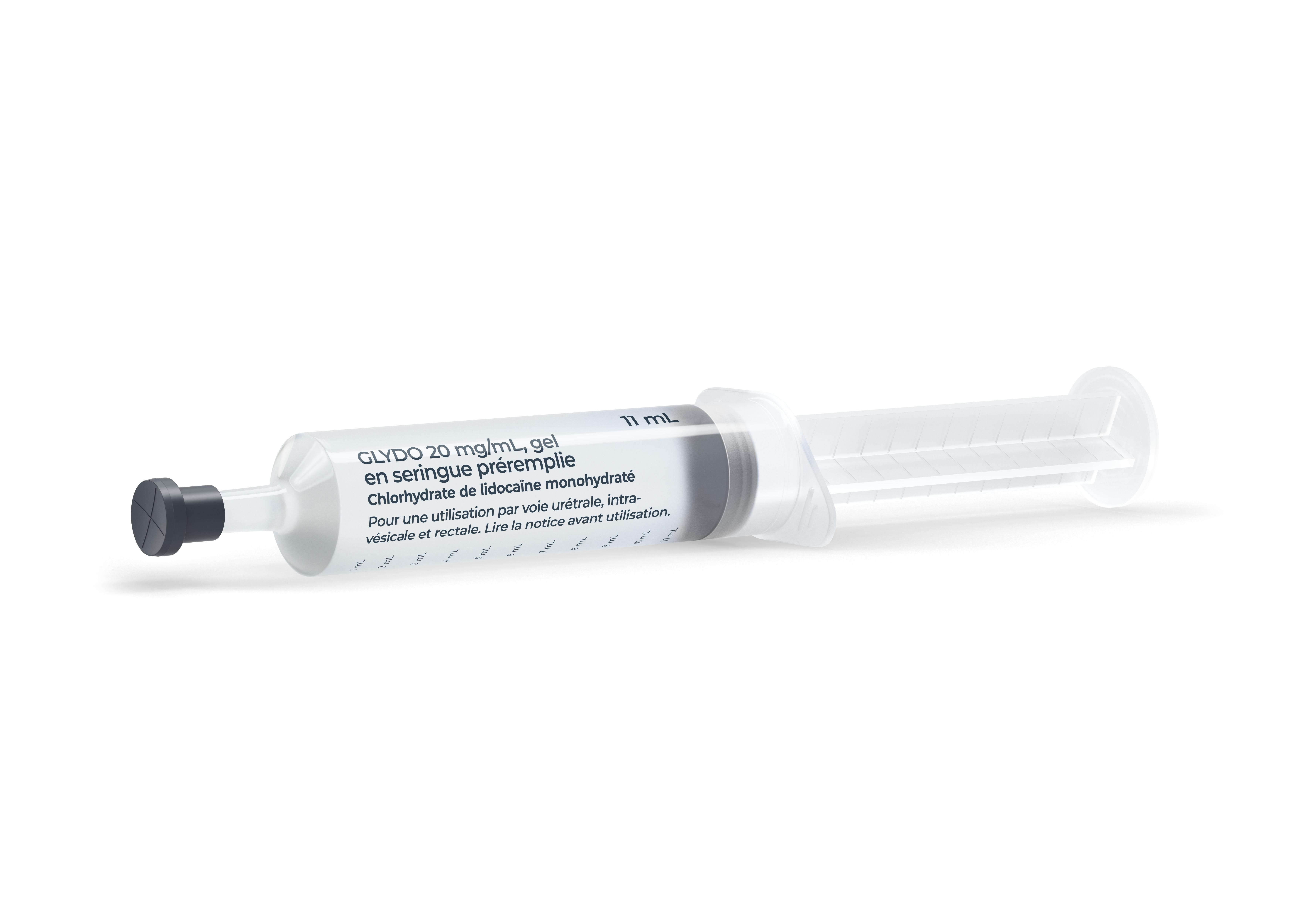
Gel (clair, presque incolore, stérile, de pH 6,5).
Seringue préremplie, graduée*, contenant 11 mL de gel. L'embout de la seringue ne permet pas de fixer une aiguille.
Boîte de 10 seringues, conditionnées sous plaquettes stériles.
* Chaque graduation de la seringue équivaut à environ 1 mL de gel.
 Galénique à la date du 23 novembre 2023
Galénique à la date du 23 novembre 2023
COMPOSITION |
1 mL de gel contient 20,1 mg de chlorhydrate de lidocaïne équivalant à 21,5 mg de chlorhydrate de lidocaïne monohydraté.
Une seringue préremplie de 11 mL contient 221,10 mg de chlorhydrate de lidocaïne.
Hypromellose, hydroxyde de sodium (pour l'ajustement du pH), eau purifiée.
INDICATIONS |
GLYDO est destiné à l'anesthésie locale de contact et la lubrification :
GLYDO est indiqué chez les adultes, les adolescents et les enfants à partir de 2 ans.
POSOLOGIE ET MODE D'ADMINISTRATION |
Connectez-vous pour accéder à ce contenu
CONTRE-INDICATIONS |
Connectez-vous pour accéder à ce contenu
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
Absorption excessive
Une dose excessive, ou des intervalles courts entre les doses, peuvent entraîner des taux plasmatiques élevés et des effets indésirables graves. Il faut informer les patients qu'ils doivent respecter strictement la posologie et les directives d'administration recommandées (la prise en charge des effets indésirables graves peut nécessiter l'utilisation de matériel de réanimation, d'oxygène ou d'autres médicaments de réanimation).
L'absorption par la surface des plaies et les muqueuses est relativement élevée. En raison de la possibilité d'une absorption systémique importante avec un risque accru de symptômes toxiques, tels que des convulsions, GLYDO 20 mg/mL gel doit être utilisé avec prudence chez les patients présentant une septicémie et/ou une muqueuse lésée dans la région d'application proposée.
Si une quantité supérieure à la quantité recommandée est instillée lors d'une anesthésie urétrale et qu'une quantité significative de gel pénètre dans la vessie, ou si l'urètre est enflammé ou ulcéré, cela peut généralement conduire à une absorption accrue de lidocaïne et, par conséquent, à un surdosage avec des effets indésirables nerveux centraux et cardiovasculaires (voir également rubrique Surdosage), en particulier chez les enfants et les patients âgés.
Si la dose ou l'administration est susceptible d'entraîner des taux sanguins élevés, certains patients doivent faire l'objet d'une attention particulière pour éviter des effets indésirables potentiellement dangereux :
Antiarythmiques de classe III
Les patients traités par des médicaments antiarythmiques de classe III (par exemple l'amiodarone) doivent faire l'objet d'une surveillance étroite. Une surveillance ECG doit être envisagée, car les effets cardiaques peuvent être additifs (voir rubrique Interactions).
Méthémoglobinémie
Des cas de méthémoglobinémie ont été rapportés en association avec l'utilisation d'anesthésiques locaux. Les patients présentant un défaut de la glucose-6-phosphate déshydrogénase, une méthémoglobinémie héréditaire ou idiopathique sont plus sensibles aux signes de méthémoglobinémie induits par les substances actives. Chez les patients présentant un déficit en glucose-6-phosphate déshydrogénase, l'antidote bleu de méthylène est inefficace pour réduire la méthémoglobine et est capable d'oxyder l'hémoglobine elle-même ; le traitement au bleu de méthylène ne peut donc pas être administré.
Patients atteints de porphyrie
La lidocaïne est possiblement porphyrinogène et ne doit être utilisée chez les patients atteints de porphyrie aiguë qu'en cas de forte indication ou en cas d'urgence et avec une surveillance étroite. Des précautions appropriées doivent être prises pour tous les patients atteints de porphyrie.
INTERACTIONS |
Connectez-vous pour accéder à ce contenu
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Grossesse
Il existe des données limitées sur l'utilisation de la lidocaïne chez la femme enceinte. La lidocaïne traverse le placenta. Les études effectuées chez l'animal n'ont pas mis en évidence d'effets délétères directs ou indirects sur la reproduction à des niveaux d'expositions pertinents pour l'application topique de la lidocaïne (voir rubrique Sécurité préclinique). La prescription de GLYDO peut être envisagée pendant la grossesse, si cela est cliniquement nécessaire.
Allaitement
La lidocaïne est excrétée dans le lait maternel, mais lorsque GLYDO est utilisé à des doses thérapeutiques, aucun effet sur chez les nouveau-nés/nourrissons allaités n'est attendu.
Fertilité
Il n'y a pas de données de l'effet de la lidocaïne sur la fertilité chez l'humain. Les études animales n'ont pas montré d'altération de la fertilité des rats mâles ou femelles (voir rubrique Sécurité préclinique).
CONDUITE et UTILISATION DE MACHINES |
Les effets sur l'aptitude à conduire et à utiliser des machines sont peu probables, mais ne peuvent être totalement exclus en cas de sensibilité individuelle accrue.
EFFETS INDÉSIRABLES |
Connectez-vous pour accéder à ce contenu
SURDOSAGE |
Symptômes
Si des symptômes de toxicité systémique apparaissent, ils sont de même nature que ceux qui surviennent après l'administration d'anesthésiques locaux par d'autres voies d'administration.
Un surdosage peut se manifester par une stimulation transitoire du système nerveux central avec les premiers symptômes suivants : bâillements, agitation, vertiges, nausées, vomissements, dysarthrie, ataxie, troubles auditifs et visuels. Une toxicité modérée peut également provoquer des contractions musculaires et des convulsions. Cela peut être suivi d'une perte de conscience, d'une dépression respiratoire et d'un coma. En cas de toxicité très grave, en raison de la contractilité réduite du myocarde et du retard de la conduction de la stimulation, une hypotension et un collapsus cardiovasculaire suivis d'un bloc cardiaque complet et d'un arrêt cardiaque sont susceptibles de survenir.
Traitement de la toxicité aiguë
Si des signes de toxicité aiguë apparaissent pendant l'administration de l'anesthésique local, celle-ci doit être immédiatement arrêtée.
Les symptômes touchant le SNC (convulsions, dépression du SNC) doivent être traités rapidement par une assistance respiratoire appropriée et l'administration d'anticonvulsivants.
En cas d'arrêt circulatoire, une réanimation cardio-pulmonaire immédiate doit être mise en place.
Une oxygénation, une ventilation et une assistance circulatoire optimales ainsi que le traitement de l'acidose ont une importance vitale.
En cas de dépression cardiovasculaire (hypotension, bradycardie), un traitement approprié par des fluides intraveineux, des agents vasopresseurs, chronotropes et/ou inotropes doivent être envisagés.
PHARMACODYNAMIE |
Connectez-vous pour accéder à ce contenu
PHARMACOCINÉTIQUE |
Connectez-vous pour accéder à ce contenu
SÉCURITÉ PRÉCLINIQUE |
Pharmacologie de sécurité
Dans les études animales, la toxicité rapportée après l'administration de fortes doses de lidocaïne a provoqué des effets sur le système nerveux central et le système cardiovasculaire.
Génotoxicité et potentiel cancérigène
Les tests de génotoxicité portant sur la lidocaïne n'ont pas mis en évidence de potentiel mutagène. Cependant, la 2,6-xylidine, un métabolite mineur de la lidocaïne, a montré un potentiel génotoxique in vitro et in vivo.
Aucune étude de cancérogénicité portant sur la lidocaïne n'a été réalisée. Il a été démontré que la 2,6-xylidine a un potentiel cancérigène (tumeurs nasales et sous-cutanées ainsi qu'un taux accru de tumeurs hépatiques) dans des études toxicologiques précliniques évaluant l'exposition chronique chez le rat. Des doses élevées de 2,6-xylidine étaient nécessaires pour induire des tumeurs dans les études animales. La pertinence clinique de l'effet inducteur de tumeurs de ce métabolite de la lidocaïne après une utilisation intermittente comme anesthésique local est inconnue.
Toxicité pour la reproduction et le développement
La lidocaïne n'a pas eu d'effet sur le développement embryo-foetal ni d'effet tératogène dans les études de reproduction réalisées chez le rat à des doses allant jusqu'à 500 mg/kg/jour de lidocaïne. Dans les études sur la toxicité pour la reproduction, des effets embryotoxiques ou fœtotoxiques de la lidocaïne ont été détectés à des doses de 25 mg/kg s.c. chez le lapin. Aucune altération de la fertilité des rats mâles ou femelles due à la lidocaïne n'a été observée.
DURÉE DE CONSERVATION |
3 ans.
PRÉCAUTIONS PARTICULIÈRES DE CONSERVATION |
Ce médicament ne nécessite pas de précautions particulières de conservation concernant la température.
Conserver les plaquettes dans l'emballage extérieur à l'abri de la lumière.
PRÉCAUTIONS PARTICULIÈRES D'ÉLIMINATION ET DE MANIPULATION |
Le produit est à usage unique. La seringue et tout gel non utilisé doivent être éliminés conformément à la réglementation en vigueur.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
Liste II
| AMM |
|
| Prix : |
|
Remb Séc soc à 65 % et agréé Collect uniquement dans l’indication « anesthésie locale de contact et la lubrification lors d'interventions de cystoscopie, de cathétérisme, d'exploration instrumentale et d'autres opérations endo-urétrales chez l'homme et la femme, uniquement, à partir de l'âge de 12 ans ».
