Classification pharmacothérapeutique VIDAL
Cancérologie - Hématologie > Traitements associés > Antiémétiques > Antagonistes de la dopamine (Benzamides)
Gastro - Entéro - Hépatologie > Nausées et vomissements > Antagonistes de la dopamine > Benzamides (Métoclopramide)
Classification ATC
VOIES DIGESTIVES ET METABOLISME > MEDICAMENTS DES DESORDRES FONCTIONNELS GASTRO-INTESTINAUX > STIMULANTS DE LA MOTRICITE INTESTINALE > STIMULANTS DE LA MOTRICITE INTESTINALE (METOCLOPRAMIDE)
Excipients
hyétellose,
sodium cyclamate,
saccharine sodique,
acide citrique monohydrate,
eau purifiée aromatisant : abricot-orange arôme, orange essence : solution alcoolique, citron essence : solution alcoolique, vanilline, benzaldéhyde, ionone, linalol, isoamyle hexanoate, éthyle hexanoate, propylèneglycol
Excipients à effet notoire :
EEN sans dose seuil : p-hydroxybenzoate de méthyle, p-hydroxybenzoate de propyle, alcool benzylique, éthanol
Présentation
PRIMPERAN 0,1 % S buv édulcorée au cyclamate sod et saccharine sod Fl/200ml
Cip : 3400930861431
Modalités de conservation : Avant ouverture : durant 30 mois (Conserver à l'abri de la lumière, Conserver dans son emballage)
| | par ml |
Métoclopramide chlorhydrate anhydre
| 1 mg |
Excipients : hyétellose, cyclamate de sodium, saccharine sodique, acide citrique monohydraté, arôme abricot-orange (extrait hydro-alcoolo soluble d'essences d'orange et de citron, vanilline, aldéhyde benzoïque, ionones, alcool benzylique, linalol, isoamyle caproate, éthyle caproate, éthanol, propylèneglycol), eau purifiée.
Conservateurs : parahydroxybenzoates de méthyle (E 218) et de propyle (E 216).
Excipients à effet notoire : parahydroxybenzoate de méthyle (E218), parahydroxybenzoate de propyle (E216), éthanol 49 mg par dose de 10 mg.
-
Population adulte :
- Primpéran 0,1 % solution buvable est indiqué chez l'adulte dans :
- la prévention des nausées et vomissements retardés induits par les antimitotiques,
- la prévention des nausées et vomissements induits par une radiothérapie,
- le traitement symptomatique des nausées et vomissements, incluant les nausées et vomissements induits par une crise migraineuse. Dans les crises migraineuses, le métoclopramide peut être utilisé en association avec des analgésiques oraux pour améliorer leur absorption.
-
Population pédiatrique :
- Primpéran 0,1 % solution buvable est indiqué chez l'enfant âgé de 1 à 18 ans dans la prévention, en deuxième intention, des nausées et vomissements retardés induits par les antimitotiques.
POSOLOGIE ET MODE D'ADMINISTRATION |
Connectez-vous pour accéder à ce contenu
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
-
Troubles neurologiques :
- Des troubles extrapyramidaux peuvent survenir, en particulier chez l'enfant et l'adulte jeune, et/ou quand des doses élevées sont utilisées. Ces réactions surviennent, en général, en début de traitement et peuvent apparaître après une seule administration. En cas d'apparition de ces symptômes extrapyramidaux, il convient d'arrêter immédiatement le métoclopramide. Ces effets sont, en général, complètement réversibles après l'arrêt du traitement, mais peuvent nécessiter un traitement symptomatique (benzodiazépines chez l'enfant, et/ou antiparkinsoniens anticholinergiques chez l'adulte).
- Un intervalle d'au moins six heures doit être respecté entre chaque prise (cf Posologie et Mode d'administration), même en cas de vomissements ou de rejet de la dose, afin d'éviter un surdosage.
- Le traitement prolongé par métoclopramide peut entraîner des dyskinésies tardives, potentiellement irréversibles en particulier chez le sujet âgé. La durée de traitement ne doit pas être supérieure à 3 mois en raison du risque de dyskinésie tardive (cf Effets indésirables). En cas d'apparition de signes cliniques de dyskinésie tardive, le traitement doit être arrêté.
- Un syndrome malin des neuroleptiques a été décrit avec le métoclopramide en association avec des neuroleptiques ou en monothérapie (cf Effets indésirables). Le métoclopramide doit être arrêté immédiatement en cas de survenue de symptômes de syndrome malin des neuroleptiques et un traitement approprié doit être mis en œuvre.
- Une attention particulière sera portée chez les patients ayant des pathologies neurologiques sous-jacentes et chez les patients traités par d'autres médicaments ayant une action centrale (cf Contre-indications).
- Les symptômes de la maladie de Parkinson peuvent également être exacerbés par le métoclopramide.
-
Méthémoglobinémie :
- Des cas de méthémoglobinémie, pouvant être dus à un déficit en NADH cytochrome-b5 réductase, ont été rapportés. Dans ce cas, le traitement doit être arrêté immédiatement et définitivement, et les mesures appropriées doivent être prises (tel que le traitement par le bleu de méthylène).
-
Troubles cardiaques :
- Des effets indésirables cardiovasculaires graves incluant des cas de bradycardie sévère, de collapsus cardiovasculaire, d'arrêt cardiaque et d'allongement de l'intervalle QT ont été rapportés lors de l'administration de métoclopramide par voie injectable, en particulier par voie intraveineuse (cf Effets indésirables).
- Le métoclopramide doit être administré avec précaution, en particulier par voie intraveineuse chez les sujets âgés, les patients ayant des troubles de la conduction cardiaque (incluant un allongement de l'intervalle QT), les patients présentant un déséquilibre de la balance électrolytique, une bradycardie et ceux prenant d'autres médicaments connus pour allonger l'intervalle QT.
-
Insuffisance rénale et hépatique :
- En cas d'insuffisance rénale ou hépatique sévère, il est recommandé de diminuer la posologie (cf Posologie et Mode d'administration).
-
Excipients à effet notoire :
- Ce médicament contient du parahydroxybenzoate de méthyle et de propyle et peut provoquer des réactions allergiques (éventuellement retardées).
- Ce médicament contient moins de 1 mmol (23 mg) de sodium par dose, c'est-à-dire qu'il est essentiellement « sans sodium ».
- Ce médicament contient 49 mg d'éthanol par dose de 10 mg de métoclopramide (10 ml de solution buvable) équivalent à 4,9 mg/ml (0,49 % p/v). La quantité par dose de 10 mg équivaut à moins de 2 ml de bière ou moins de 1 ml de vin. La faible quantité d'éthanol contenue dans ce médicament n'est pas susceptible d'entraîner d'effet notable.
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Grossesse :
Un nombre important de données chez la femme enceinte (plus de 1 000 grossesses) n'a mis en évidence aucun effet malformatif, ni fœtotoxique. Le métoclopramide peut être utilisé au cours de la grossesse si nécessaire. Pour des raisons pharmacologiques (par analogie avec d'autres neuroleptiques), si le métoclopramide est administré en fin de grossesse, un syndrome extrapyramidal néonatal ne peut être exclu. Le métoclopramide doit être évité en fin de grossesse. S'il est utilisé, une surveillance du nouveau-né doit être mise en œuvre.
Allaitement :
Le métoclopramide passe faiblement dans le lait maternel. Des effets indésirables chez le nouveau-né allaité ne peuvent être exclus. Par conséquent, le métoclopramide n'est pas recommandé pendant l'allaitement. Une interruption du traitement pendant l'allaitement doit être envisagée.
CONDUITE et UTILISATION DE MACHINES |
Le métoclopramide peut entraîner une somnolence, des étourdissements, une dyskinésie et des dystonies qui peuvent affecter la vision et également interférer avec la capacité à conduire des véhicules et à utiliser des machines.
-
Symptômes :
- Des symptômes extrapyramidaux, une somnolence, des troubles de la conscience, une confusion, des hallucinations, une crise hypertensive, voire un arrêt cardiorespiratoire peuvent survenir.
-
Conduite à tenir :
- En cas de symptômes extrapyramidaux liés ou non à un surdosage, le traitement est uniquement symptomatique (benzodiazépines chez l'enfant, et/ou antiparkinsoniens anticholinergiques chez l'adulte).
- Un traitement symptomatique et une surveillance continue des fonctions cardiovasculaire et respiratoire doivent être mis en œuvre en fonction de l'état clinique.
MODALITÉS DE CONSERVATION |
Durée de conservation : 30 mois.
Conserver le flacon dans l'emballage extérieur, à l'abri de la lumière.
MODALITÉS MANIPULATION/ÉLIMINATION |
Pas de précautions particulières d'élimination.
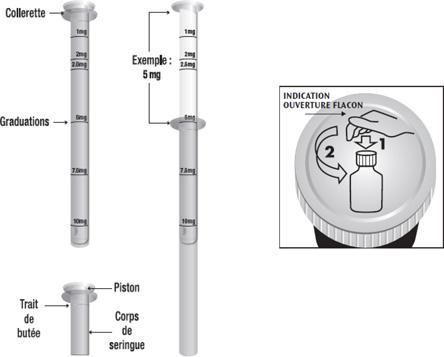
Pour ouvrir le flacon, il faut tourner le bouchon sécurité-enfant en appuyant dessus.
Le flacon doit être refermé après chaque utilisation.
Ce médicament s'administre par voie orale avec une seringue pour administration orale en polyéthylène/polystyrène, graduée en milligramme (mg) avec mention de 1 mg - 2 mg - 2,5 mg - 5 mg - 7,5 mg - 10 mg. Elle porte la mention « Métoclopramide 1 mg/ml ».
La dose à administrer pour une prise est obtenue en tirant le piston jusqu'à la graduation correspondante à la dose prescrite. La dose se lit au niveau de la collerette de la seringue pour administration orale. Un trait de butée est disposé sur la partie haute du corps de la seringue pour administration orale, afin de bloquer les deux éléments et éviter qu'ils ne se séparent lors de l'utilisation de la seringue pour administration orale. Le trait de butée ne sert pas à la mesure de la dose.
Par exemple : pour prélever la dose à administrer de 2 mg, tirer le piston jusqu'à ce que la graduation 2 mg inscrite sur le piston atteigne la collerette de la seringue pour administration orale.
Après utilisation, refermer le flacon de la solution buvable. La seringue ne doit pas rester tremper dans le flacon. La seringue pour administration orale doit être rincée avec de l'eau puis séchée après chaque utilisation. Puis ranger immédiatement la seringue pour administration orale dans sa boîte dans un endroit inaccessible aux enfants. Ne jamais séparer la seringue pour administration orale des autres éléments de conditionnement du médicament (flacon, boîte, notice).
L'usage de la seringue pour administration orale est strictement réservé à l'administration de Primpéran 0,1 %, solution buvable.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
LISTE I
| AMM | 3400930861431 (1964/97, RCP rév 23.06.2023). |
| | |
| Prix : | 1,92 euros (flacon de 200 ml). |
| Remb Séc soc à 30 %. Collect. |