Classification pharmacothérapeutique VIDAL
Hémostase - Hématopoïèse - Hémoglobinopathies > Antihémorragiques (Facteurs sanguins de la coagulation)
Classification ATC
SANG ET ORGANES HEMATOPOIETIQUES > ANTIHEMORRAGIQUES > VITAMINE K ET AUTRES HEMOSTATIQUES > FACTEURS DE LA COAGULATION SANGUINE (FACTEUR IX DE COAGULATION)
Excipients
saccharose,
mannitol,
sodium chlorure,
calcium chlorure,
histidine,
polysorbate 80 excipient du solvant : eau ppi
Excipients à effet notoire :
EEN avec dose seuil : sodium
Présentation
RIXUBIS 250 UI Pdre/solv p sol inj Fl/5ml+Disp
Cip : 3400955003960
Modalités de conservation : Avant ouverture : < 30° durant 36 mois (Ne pas congeler)
| Poudre : | p flacon |
Nonacog gamma* (DCI) (facteur IX de coagulation humain recombinant (ADNr))
| 250 UI |
| ou | 500 UI |
| ou | 1000 UI |
| ou | 2000 UI |
| ou | 3000 UI |
Excipients (communs) :
saccharose, mannitol, chlorure de sodium, chlorure de calcium, L-histidine, polysorbate 80.
Solvant : eau pour préparations injectables stérilisée.
Excipient à effet notoire : sodium (19 mg par flacon).
La solution reconstituée contient approximativement 50 UI/ml (Rixubis 250 UI), 100 UI/ml (Rixubis 500 UI), 200 UI/ml (Rixubis 1000 UI), 400 UI/ml (Rixubis 2000 UI) ou 600 UI/ml (Rixubis 3000 UI) de nonacog gamma.
L'activité (UI) est déterminée à l'aide de l'épreuve de coagulation en une étape de la Pharmacopée européenne. L'activité spécifique de Rixubis est d'environ 200-390 UI/mg de protéine.
* Le nonacog gamma (facteur IX de coagulation recombinant) est une glycoprotéine purifiée à chaîne unique comportant 415 acides aminés. Il est produit par la technologie de l'ADN recombinant sur une lignée cellulaire d'ovaire de hamster chinois (CHO).
Traitement et prophylaxie des hémorragies chez les patients atteints d'hémophilie B (déficit congénital en facteur IX).
Rixubis est indiqué chez les patients dans toutes les tranches d'âge.
POSOLOGIE ET MODE D'ADMINISTRATION |
Connectez-vous pour accéder à ce contenu
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
-
Traçabilité :
- Afin d'améliorer la traçabilité des médicaments biologiques, le nom et le numéro de lot du produit administré doivent être clairement enregistrés.
-
Hypersensibilité :
- Des réactions d'hypersensibilité de type allergique ont été rapportées avec Rixubis. Le produit contient des traces de protéines de hamster. En cas de symptômes d'hypersensibilité, les patients ou leurs soignants doivent arrêter immédiatement la prise du médicament et consulter leur médecin.
- Les patients doivent être informés des signes précoces de réactions d'hypersensibilité tels que les éruptions urticariennes, l'urticaire généralisée, l'oppression thoracique, les sibilances, l'hypotension et l'anaphylaxie.
- Le risque est maximal pendant les premières phases de l'exposition initiale aux concentrés de facteur IX chez les patients non traités précédemment (PNTP), en particulier chez ceux présentant des mutations génétiques à haut risque. Des études ont fait état d'une association entre l'apparition d'un inhibiteur du facteur IX et des réactions allergiques, en particulier chez les patients présentant une mutation génétique à haut risque. Les patients présentant des réactions allergiques doivent donc être évalués afin de détecter la présence d'un inhibiteur.
- En cas de choc, un traitement médical standard du choc doit être mis en œuvre.
-
Inhibiteurs :
- Après un traitement répété par des produits à base de facteur IX de coagulation humain (ADNr), les patients doivent être suivis afin de détecter la formation d'anticorps neutralisants (inhibiteurs) qui doivent être quantifiés en unités Bethesda (UB) à l'aide de tests biologiques appropriés.
- Des études ont fait état d'une corrélation entre la formation d'un inhibiteur du facteur IX et des réactions allergiques. Les patients présentant des réactions allergiques doivent donc être évalués afin de détecter la présence d'un inhibiteur. Il convient de noter que les patients présentant des inhibiteurs du facteur IX peuvent courir un risque plus élevé d'anaphylaxie en cas d'administration ultérieure de facteur IX.
- En raison du risque de réactions allergiques avec des concentrés de facteur IX, les premières administrations de facteur IX doivent, selon le jugement du médecin traitant, être effectuées sous observation médicale dans un environnement permettant de prodiguer les soins appropriés en cas de réaction allergique.
-
Syndrome néphrotique :
- Des cas de syndrome néphrotique ont été signalés après une tentative d'induction de tolérance immune chez des patients atteints d'hémophilie B et ayant des inhibiteurs du facteur IX.
-
Thromboembolie :
- En raison du risque de complications thrombotiques, une surveillance clinique visant à détecter les premiers signes de coagulopathie de consommation et de thrombose doit être mise en place avec des tests biologiques appropriés lors de l'administration de ce produit à des patients atteints de pathologies hépatiques, à des patients en phase post-opératoire, à des nouveau-nés ou à des patients présentant un risque de phénomène thrombotique ou de CIVD. Dans chacune de ces situations, les bénéfices du traitement par Rixubis doivent être comparés au risque de survenue de ces complications.
-
Événements cardiovasculaires :
- L'administration d'un traitement de substitution du facteur IX peut augmenter les risques cardiovasculaires chez les patients présentant des facteurs de risque cardiovasculaires.
-
Complications liées au cathéter :
- Si un dispositif d'accès veineux central (DAVC) est requis, le risque de complications liées au DAVC, telles que des infections locales, une bactériémie et une thrombose au site du cathéter, doit être pris en compte.
-
Considérations liées aux excipients :
- Ce médicament contient moins de 1 mmol de sodium par flacon (23 mg), c'est-à-dire qu'il est essentiellement « sans sodium ». Selon le poids corporel et la posologie de Rixubis, il se peut qu'un patient reçoive plus d'un flacon. Ceci doit être pris en considération si le patient suit un régime hyposodé.
-
Personnes âgées :
- Les études cliniques sur Rixubis n'ont pas inclus de sujets âgés de 65 ans ou plus. Nous ignorons s'ils répondent différemment des sujets plus jeunes. Comme chez tous les patients, la sélection de la dose chez un patient âgé doit être personnalisée.
-
Population pédiatrique :
- Les mises en garde et précautions d'emploi mentionnées s'appliquent aux adultes comme aux enfants.
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Grossesse :
Il n'existe pas de données ou il existe des données limitées sur l'utilisation du facteur IX chez la femme enceinte. Aucune étude de reproduction sur l'animal n'a été menée avec le facteur IX. Par conséquent, le facteur IX ne doit être administré qu'en cas de nécessité absolue au cours de la grossesse et de l'allaitement.
Allaitement :
On ne sait pas si le facteur IX/métabolites sont excrétés dans le lait maternel.
Fertilité :
Il n'existe aucune information sur les effets du facteur IX recombinant sur la fertilité.
CONDUITE et UTILISATION DE MACHINES |
Rixubis n'a aucun effet sur l'aptitude à conduire des véhicules et à utiliser des machines.
Les effets de doses de Rixubis supérieures à celles recommandées n'ont pas été décrits.
Rixubis n'a pas montré de risque thrombogène à une dose de 750 UI/kg dans un modèle de stase chez le lapin (test de Wessler).
Rixubis n'a entraîné aucun effet indésirable cardiovasculaire, respiratoire ou clinique jusqu'à la dose de 450 UI/kg chez le singe cynomolgus.
Aucune investigation n'a été menée chez l'animal concernant la carcinogénicité, les troubles de la fertilité et le développement fœtal.
Rixubis a été bien toléré lors d'études de toxicité en dose unique et en administration répétée chez la souris, le rat et le singe cynomolgus à des doses maximales de 7 500 UI/kg (dose unique) et de 750 UI/kg (administration répétée).
En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé avec d'autres médicaments.
N'utiliser que des seringues luer-lock en plastique avec ce produit. Une dose incorrecte peut être due à une adsorption du facteur IX de coagulation humain par les surfaces internes de certains équipements de perfusion.
MODALITÉS DE CONSERVATION |
Durée de conservation : 3 ans.
A conserver et transporter à une température ne dépassant pas 30 °C. Ne pas congeler.
-
Après ouverture :
- La stabilité physico-chimique après ouverture de l'emballage a été démontrée pendant 3 heures à une température ne dépassant pas 30 °C. D'un point de vue microbiologique, à moins que la méthode de reconstitution n'exclue tout risque de contamination microbienne, le produit doit être utilisé immédiatement. Si le produit n'est pas utilisé immédiatement, l'utilisateur sera responsable de la durée et des conditions de conservation. Ne pas mettre au réfrigérateur.
MODALITÉS MANIPULATION/ÉLIMINATION |
Rixubis doit être administré par voie intraveineuse après reconstitution de la poudre avec le solvant fourni.
- Pour la reconstitution, utiliser uniquement le solvant et le dispositif de reconstitution (Baxject II) fournis dans l'emballage.
- L'utilisation d'une seringue luer-lock est requise pour l'administration.
- Ne pas utiliser si le dispositif Baxject II, son système de protection stérile ou son emballage est endommagé ou montre des signes de détérioration.
-
Reconstitution :
- Procédez de manière aseptique.
-
- Si le produit est conservé au réfrigérateur, sortez les flacons de solvant et de poudre Rixubis du réfrigérateur et laissez-les revenir à température ambiante (entre 15 °C et 30 °C).
- Lavez-vous bien les mains à l'eau chaude et au savon.
- Décapsulez les flacons de poudre et de solvant.
- Nettoyez les bouchons à l'aide de tampons imbibés d'alcool. Placez les flacons sur une surface plane et propre.
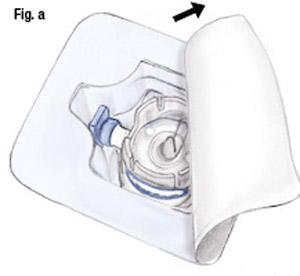
- Ouvrez l'emballage du dispositif Baxject II en détachant la protection de papier sans toucher l'intérieur (fig a). Ne sortez pas le dispositif de l'emballage.
- Retournez l'emballage et insérez le perforateur en plastique transparent à travers le bouchon de solvant. Tenez l'emballage par les bords et retirez l'emballage de Baxject II (fig b).
Ne retirez pas le capuchon bleu du dispositif Baxject II.
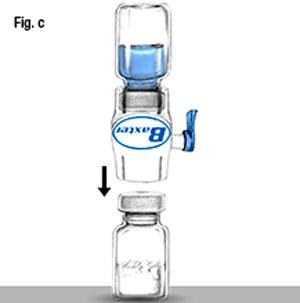
- Avec Baxject II fixé au flacon de solvant, retournez le système de manière à ce que le flacon de solvant se trouve au-dessus du dispositif. Enfoncez le perforateur en plastique blanc à travers le bouchon de Rixubis. Le vide aspirera le solvant dans le flacon de Rixubis (fig c).
- Agitez délicatement jusqu'à ce que la dissolution soit terminée. Le produit se dissout rapidement (dans les 2 minutes). Assurez-vous que la poudre Rixubis est entièrement dissoute, sans quoi l'intégralité de la solution reconstituée ne traversera pas le filtre du dispositif. Les médicaments reconstitués doivent être contrôlés visuellement afin de détecter d'éventuelles particules ou décolorations avant administration. La solution doit être limpide ou légèrement opalescente. N'utilisez pas de solutions troubles ou présentant des dépôts.
- Ne réfrigérez pas la préparation après reconstitution.
- Utilisez immédiatement.
-
Administration :
- Procédez de manière aseptique.
-
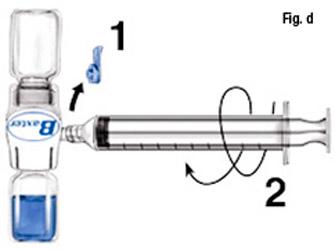
- Retirez le capuchon bleu de Baxject II. N'aspirez pas d'air dans la seringue. Connectez la seringue à Baxject II (fig d).
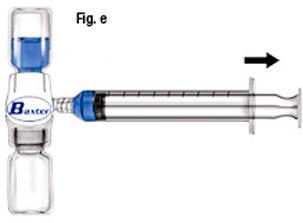
- Retournez le système (le flacon contenant la solution reconstituée doit se trouver au-dessus).
Aspirez la solution reconstituée dans la seringue en tirant lentement sur le piston (fig e).
- Détachez la seringue.
- Fixez une aiguille à ailettes à la seringue. Injectez par voie intraveineuse. La solution doit être administrée lentement, à une vitesse adaptée au niveau de confort du patient, sans dépasser 10 ml par minute.
- Si possible, notez le nom du produit et son numéro de lot à chaque fois que vous utilisez Rixubis (p ex dans votre carnet) afin d'assurer la traçabilité des produits et des lots utilisés.
- Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
LISTE I
| Prescription initiale hospitalière de 6 mois. |
| Délivrance réservée aux pharmacies à usage intérieur des établissements de santé. |
| AMM | EU/1/14/970/001 ; CIP 3400955003960 (RCP rév 14.11.2019) 250 UI (flacon + flacon solvant). |
| EU/1/14/970/002 ; CIP 3400955003984 (RCP rév 14.11.2019) 500 UI (flacon + flacon solvant). |
| EU/1/14/970/003 ; CIP 3400955003991 (RCP rév 14.11.2019) 1000 UI (flacon + flacon solvant). |
| EU/1/14/970/004 ; CIP 3400955004004 (RCP rév 14.11.2019) 2000 UI (flacon + flacon solvant). |
| EU/1/14/970/005 ; CIP 3400955004011 (RCP rév 14.11.2019) 3000 UI (flacon + flacon solvant). |
| Collect, inscrit sur la liste de rétrocession avec prise en charge à 100 % et inscrit sur la liste des spécialités prises en charge en sus des GHS dans la seule indication « traitement et prophylaxie des épisodes hémorragiques chez les patients atteints d'hémophilie B ». |
| Prix ou tarif de responsabilité (HT) par UCD : | UCD 3400894074472 (Fl + fl solv à 250 UI) : 162,00 euros. |
| UCD 3400894074533 (Fl + fl solv à 500 UI) : 324,00 euros. |
| UCD 3400894074243 (Fl + fl solv à 1000 UI) : 648,00 euros. |
| UCD 3400894074304 (Fl + fl solv à 2000 UI) : 1296,00 euros. |
| UCD 3400894076193 (Fl + fl solv à 3000 UI) : 1944,00 euros. |
Titulaire de l'AMM : Baxalta Innovations GmbH, Industriestrasse 67, A-1221 Vienne, Autriche.