Veuillez saisir au moins 3 caractères pour votre recherche.
- Médicaments
- ROTARIX
- ROTARIX susp buv en tube souple Vaccin à rotavirus, vivant
Mise à jour : 17 octobre 2023
Sommaire
SYNTHÈSE |
EEN sans dose seuil : saccharose, phénylalanine, glucose
EEN avec dose seuil : sodium
Cip : 3400939020228
Modalités de conservation : Avant ouverture : 2° < t < 8° durant 36 mois (Conserver à l'abri de la lumière, Conserver au réfrigérateur, Conserver dans son emballage, Ne pas congeler)
FORMES et PRÉSENTATIONS |
COMPOSITION |
| par dose de 1,5 ml | ||
| Rotavirus humain, souche RIX4414 (vivante atténuée)* | ≥ 106.0 DICC50 | |
Excipients à effet notoire : ce produit contient 1073 mg de saccharose, 32 mg de sodium, 10 microgrammes de glucose et 0,15 microgramme de phénylalanine par dose (cf Mises en garde et Précautions d'emploi).
* Produite sur cellules Vero.INDICATIONS |
POSOLOGIE ET MODE D'ADMINISTRATION |
Connectez-vous pour accéder à ce contenu
CONTRE-INDICATIONS |
Connectez-vous pour accéder à ce contenu
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
La vaccination doit être précédée d'une recherche des antécédents médicaux, notamment concernant les contre-indications, et d'un examen clinique.
Il n'y a aucune donnée de tolérance et d'efficacité de Rotarix chez les nourrissons ayant une pathologie gastro-intestinale ou un retard de croissance. L'administration de Rotarix peut être considérée avec prudence chez ces nourrissons quand, selon l'avis du médecin, le fait de différer la vaccination entraîne un risque plus grand.
Par mesure de précaution, les professionnels de santé doivent surveiller tout symptôme évocateur d'une invagination intestinale (douleurs abdominales sévères, vomissements persistants, présence de sang dans les selles, ballonnements abdominaux et/ou fièvre élevée) car les données issues d'études observationnelles de tolérance indiquent une augmentation du risque d'invagination intestinale, principalement dans les 7 jours suivant l'administration d'un vaccin à rotavirus (cf Effets indésirables). Il doit être recommandé aux parents/tuteurs de rapporter immédiatement de tels symptômes à leurs professionnels de santé.
Pour les sujets ayant une prédisposition aux invaginations intestinales, cf Contre-indications.
Une altération de la tolérance ou de l'efficacité de Rotarix n'est pas attendue dans le cas d'une infection par le VIH asymptomatique ou légèrement symptomatique. Un essai clinique réalisé chez un nombre limité de nourrissons séropositifs au VIH et asymptomatiques ou légèrement symptomatiques n'a montré aucun problème apparent de tolérance (cf Effets indésirables).
L'administration de Rotarix à des nourrissons ayant une immunodéficience connue ou suspectée, y compris suite à une exposition in utero à un traitement immunosuppresseur, doit être soigneusement évaluée compte tenu des bénéfices et des risques potentiels.
L'excrétion du virus vaccinal dans les selles est connue pour survenir après vaccination avec un pic d'excrétion vers le 7e jour. Les particules antigéniques virales détectées par ELISA ont été retrouvées dans 50 % des selles après la 1re dose de Rotarix formulation lyophilisée et dans 4 % des selles après la seconde dose. Quand la présence de souche vaccinale vivante a été recherchée dans les selles, seules 17 % des selles étaient positives. Dans 2 essais comparatifs contrôlés, l'élimination du vaccin après vaccination par Rotarix formulation liquide était comparable à celle observée après vaccination par Rotarix formulation lyophilisée.
Des cas de transmission de ces virus vaccinaux excrétés ont été observés chez des sujets contacts sans symptôme clinique associé.
Rotarix doit être administré avec prudence chez les personnes en contact proche avec des patients immunodéprimés, tels que des patients atteints d'affections malignes ou des patients sous traitement immunosuppresseur.
Les personnes en contact avec des sujets récemment vaccinés doivent observer des règles d'hygiène personnelle (telles que se laver les mains après avoir changé les couches du nourrisson).
Le risque potentiel d'apnée avec nécessité de surveillance respiratoire pendant 48-72 h doit être soigneusement pris en compte lors de l'administration des deux doses vaccinales chez les très grands prématurés (nés à 28 semaines de grossesse ou moins) et particulièrement chez ceux ayant des antécédents d'immaturité respiratoire.
En raison du bénéfice élevé de la vaccination chez ces nourrissons, l'administration ne doit pas être suspendue ou reportée.
Une réponse immunitaire protectrice peut ne pas être obtenue chez tous les sujets vaccinés (cf Pharmacodynamie).
L'étendue de la protection que Rotarix pourrait conférer à d'autres souches de rotavirus qui n'ont pas circulé lors des essais cliniques n'est actuellement pas connue. Les données d'efficacité sont issues d'études cliniques réalisées en Europe, en Amérique centrale et du Sud, en Afrique et en Asie (cf Pharmacodynamie).
Rotarix ne protège pas contre les gastro-entérites dues à des pathogènes autres que les rotavirus.
Aucune donnée n'est disponible concernant l'utilisation de Rotarix en prophylaxie postexposition.
Rotarix ne doit jamais être injecté.
INTERACTIONS |
Connectez-vous pour accéder à ce contenu
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Rotarix n'est pas destiné à l'adulte. Il n'y a pas de données concernant l'utilisation du vaccin chez la femme pendant la grossesse et l'allaitement.
D'après les données issues des essais cliniques, l'allaitement ne réduit pas la protection contre les gastro-entérites à rotavirus, conférée par Rotarix. Ainsi, l'allaitement peut être poursuivi pendant le schéma de vaccination.
EFFETS INDÉSIRABLES |
Connectez-vous pour accéder à ce contenu
SURDOSAGE |
Des cas de surdosage ont été rapportés. En général, les événements indésirables rapportés dans ces cas étaient similaires à ceux observés après l'administration de la dose recommandée de Rotarix.
PHARMACODYNAMIE |
Connectez-vous pour accéder à ce contenu
PHARMACOCINÉTIQUE |
Connectez-vous pour accéder à ce contenu
SÉCURITÉ PRÉCLINIQUE |
Les données non cliniques issues des études conventionnelles de toxicologie en administration répétée n'ont pas révélé de risque particulier pour l'Homme.
INCOMPATIBILITÉS |
En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé avec d'autres médicaments.
MODALITÉS DE CONSERVATION |
A conserver au réfrigérateur (entre 2 °C et 8 °C).
Ne pas congeler.
Conserver dans l'emballage extérieur d'origine, à l'abri de la lumière.
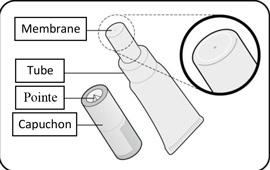
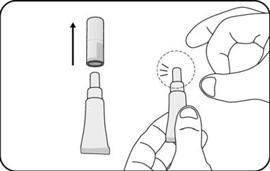
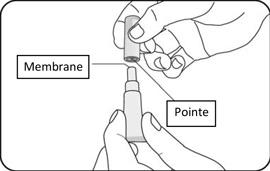
MODALITÉS MANIPULATION/ÉLIMINATION |
Le vaccin se présente sous la forme d'un liquide limpide, incolore, exempt de particules visibles, pour administration orale.
Le vaccin est prêt à l'emploi (aucune reconstitution ou dilution n'est requise).
Le vaccin doit être administré oralement et ne doit pas être mélangé à d'autres vaccins ou solutions.
Le vaccin doit être inspecté visuellement pour mettre en évidence la présence de toute particule étrangère et/ou changement de l'aspect physique avant administration. Dans l'un et/ou l'autre cas, jetez le vaccin.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
 |
 |
 |
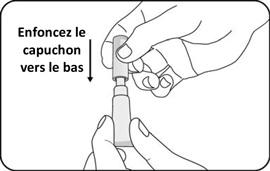 |
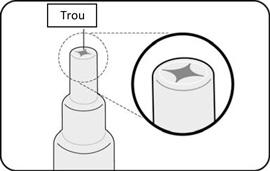 |
 |
Jetez le tube vide et le capuchon dans des conteneurs biologiques prévus à cet effet selon les recommandations locales.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| AMM | EU1/05/330/009 ; CIP 3400939020228 (2008, RCP rév 28.07.2023) 1 tube souple. |
| Prix : | 58,45 euros (1 tube souple). |
| Remb Séc soc à 65 % et Collect. dans l'indication « immunisation active des nourrissons de l'âge de 6 semaines à 24 semaines pour la prévention des gastro-entérites dues à une infection à rotavirus, selon les recommandations en vigueur de la HAS datant du 23 juin 2022 ». | |
Titulaire de l'AMM : GlaxoSmithKline Biologicals SA, Rixensart, Belgique.