Veuillez saisir au moins 3 caractères pour votre recherche.
- Médicaments
- SOTYKTU
- SOTYKTU 6 mg cp pellic
Mise à jour : 22 août 2024
Sommaire
SYNTHÈSE |
enrobage : alcool polyvinylique, macrogol, talc
colorant (enrobage) : titane dioxyde, fer rouge oxyde, fer jaune oxyde
EEN sans dose seuil : lactose anhydre
Cip : 3400930269305
Modalités de conservation : Avant ouverture : durant 24 mois
FORMES et PRÉSENTATIONS |
Comprimé pelliculé (rose, rond, biconvexe, de 8 mm de diamètre, portant les mentions « BMS 895 » et « 6 mg » gravées sur une face sur deux lignes, l'autre face étant lisse).
Boîte de 28, sous plaquettes calendaires.
COMPOSITION |
Chaque comprimé pelliculé contient 6 mg de deucravacitinib.
Excipient à effet notoire :
Chaque comprimé pelliculé contient 44 mg de lactose (voir rubrique Mises en garde et précautions d'emploi).
Noyau du comprimé : succinate d'acétate d'hypromellose, lactose anhydre, cellulose microcristalline, croscarmellose sodique, silice colloïdale hydratée, stéarate de magnésium.
Enrobage : alcool polyvinylique, dioxyde de titane (E171), macrogol, talc, oxyde de fer rouge (E172), oxyde de fer jaune (E172).
INDICATIONS |
SOTYKTU est indiqué dans le traitement du psoriasis en plaques modéré à sévère chez les adultes éligibles à un traitement systémique.
POSOLOGIE ET MODE D'ADMINISTRATION |
Connectez-vous pour accéder à ce contenu
CONTRE-INDICATIONS |
Connectez-vous pour accéder à ce contenu
MISES EN GARDE et PRÉCAUTIONS D'EMPLOI |
Infections
Le deucravacitinib peut augmenter le risque d'infections (voir rubrique Effets indésirables).
Le traitement par deucravacitinib ne doit pas être instauré chez les patients présentant une infection active importante sur le plan clinique tant que l'infection n'est pas résolue ou correctement traitée (voir rubrique Contre-indications). L'utilisation du deucravacitinib chez les patients présentant une infection chronique ou un antécédent d'infection récurrente doit être envisagée avec précaution.
Il convient d'indiquer aux patients traités par deucravacitinib de demander un avis médical en cas d'apparition de signes ou symptômes évoquant une infection. Si un patient développe une infection importante sur le plan clinique ou ne répond pas au traitement standard, le patient doit être surveillé attentivement et le deucravacitinib ne doit pas être administré tant que l'infection n'est pas résolue.
Évaluation préalable au traitement pour la tuberculose
Avant de débuter un traitement par deucravacitinib, les patients doivent effectuer un test de dépistage de l'infection par la tuberculose (TB). Le deucravacitinib ne doit pas être administré aux patients présentant une TB active (voir rubrique Contre-indications). Le traitement contre la TB latente doit être mis en place avant d'administrer deucravacitinib. Un traitement antituberculeux doit être envisagé avant d'instaurer un traitement par deucravacitinib chez les patients présentant des antécédents de TB latente ou active, chez lesquels l'administration d'un traitement adéquat ne peut être confirmée. Les patients recevant du deucravacitinib doivent être surveillés pour détecter tout signe et symptôme de TB active.
Tumeurs malignes
Des tumeurs malignes, y compris des lymphomes et des cancers cutanés non mélanomateux (CCNM), ont été observées lors des études cliniques avec deucravacitinib.
Il n'a pas été déterminé si l'inhibition de la tyrosine kinase 2 (TYK2) était possiblement associée aux effets indésirables liés à l'inhibition de Janus kinase (JAK). Dans une étude à grande échelle randomisée, contrôlée par agent actif, menée sur un inhibiteur de JAK chez des patients âgés de 50 ans et plus, souffrant de polyarthrite rhumatoïde et présentant au moins un facteur de risque cardiovasculaire supplémentaire, un taux plus élevé de tumeurs malignes, en particulier des tumeurs malignes du poumon, des lymphomes et des CCNM, a été observé avec un inhibiteur de JAK par rapport à des inhibiteurs du facteur de nécrose tumorale (TNF).
Des données cliniques limitées sont disponibles pour évaluer le lien éventuel entre l'exposition au deucravacitinib et le développement de tumeurs malignes. Une évaluation de la sécurité à long terme est en cours. Les risques et bénéfices d'un traitement par deucravacitinib doivent être pris en compte avant d'instaurer le traitement chez les patients.
Événements indésirables cardiovasculaires majeurs (EICM), thrombose veineuse profonde (TVP) et embolie pulmonaire (EP)
Il n'a pas été déterminé si l'inhibition de la TYK2 était possiblement associée aux effets indésirables liés à l'inhibition des JAK. Dans une étude à grande échelle randomisée, contrôlée par agent actif, menée sur un inhibiteur de JAK chez des patients âgés de 50 ans et plus, souffrant de polyarthrite rhumatoïde et présentant au moins un facteur de risque cardiovasculaire supplémentaire, un taux plus élevé d'EICM, correspondant à des morts cardiaques, des infarctus du myocarde d'issue non fatale et des accidents cérébrovasculaires d'issue non fatale, et un taux plus élevé de thromboembolie veineuse, notamment de TVP et d'EP, en corrélation avec la dose administrée, ont été observés avec un inhibiteur de JAK par rapport à des inhibiteurs du TNF.
Aucune augmentation du risque d'EICM, de TVP et d'EP n'a été observée dans les études cliniques avec le deucravacitinib. Des évaluations de la tolérance à long terme de deucravacitinib sont en cours. Les risques et bénéfices d'un traitement par deucravacitinib doivent être pris en compte avant d'instaurer le traitement chez les patients.
Vaccinations
Avant de débuter un traitement par deucravacitinib, il convient d'envisager la réalisation de toutes les vaccinations appropriées selon l'âge, conformément aux recommandations vaccinales en vigueur. L'utilisation de vaccins vivants atténués doit être évitée chez les patients traités par deucravacitinib. La réponse aux vaccins vivants atténués et inactivés n'a pas été évaluée.
Excipients
Lactose
Ce médicament contient du lactose. Les patients présentant une intolérance au galactose, un déficit total en lactase ou un syndrome de malabsorption du glucose et du galactose (maladies héréditaires rares) ne doivent pas prendre ce médicament.
Sodium
Ce médicament contient moins de 1 mmol (23 mg) de sodium par comprimé, c.-à-d. qu'il est essentiellement « sans sodium ».
INTERACTIONS |
Connectez-vous pour accéder à ce contenu
FERTILITÉ/GROSSESSE/ALLAITEMENT |
Grossesse
Il existe des données limitées sur l'utilisation du deucravacitinib chez la femme enceinte. Les études effectuées chez l'animal n'ont pas mis en évidence d'effets délétères directs ou indirects sur la reproduction (voir rubrique Sécurité préclinique). Par mesure de précaution, il est préférable d'éviter l'utilisation du deucravacitinib pendant la grossesse.
Allaitement
On ne sait pas si deucravacitinib/les métabolites sont excrétés dans le lait maternel.
Les données disponibles chez l'animal ont mis en évidence l'excrétion du deucravacitinib dans le lait (voir rubrique Sécurité préclinique).
Un risque pour les nouveau-nés/nourrissons en rapport avec l'allaitement ne peut être exclu. La décision d'interrompre l'allaitement ou d'interrompre/de s'abstenir du traitement avec deucravacitinib doit être prise, en prenant en compte le bénéfice de l'allaitement pour l'enfant au regard du bénéfice du traitement pour la femme.
Fertilité
L'effet du deucravacitinib sur la fertilité humaine n'a pas été évalué. Les études effectuées chez l'animal n'ont pas mis en évidence d'effets délétères directs ou indirects sur la fertilité (voir rubrique Sécurité préclinique).
CONDUITE et UTILISATION DE MACHINES |
Le deucravacitinib n'a aucun effet ou un effet négligeable sur l'aptitude à conduire des véhicules et à utiliser des machines.
EFFETS INDÉSIRABLES |
Connectez-vous pour accéder à ce contenu
SURDOSAGE |
Le deucravacitinib a été administré chez des volontaires sains sous forme de doses uniques allant jusqu'à 40 mg (> 6 fois la dose recommandée chez l'homme de 6 mg/jour) et sous forme de doses multiples allant jusqu'à 24 mg/jour (12 mg deux fois par jour) pendant 14 jours sans toxicité limitant la dose.
En cas de surdosage, il est recommandé de surveiller la survenue de signes ou symptômes d'effets indésirables et d'initier immédiatement un traitement symptomatique approprié. La dialyse n'élimine pas totalement deucravacitinib de la circulation systémique (voir rubrique Pharmacocinétique).
PHARMACODYNAMIE |
Connectez-vous pour accéder à ce contenu
PHARMACOCINÉTIQUE |
Connectez-vous pour accéder à ce contenu
SÉCURITÉ PRÉCLINIQUE |
Les données non cliniques issues des études conventionnelles de pharmacologie de sécurité, toxicologie en administration répétée, génotoxicité, cancérogenèse, et des fonctions de reproduction et de développement, n'ont pas révélé de risque particulier pour l'homme.
Toxicologie en administration répétée
Dans l'étude de toxicité chronique menée sur des rats, des diminutions des numérations de lymphocytes, des cellules de la moelle osseuse et des cellules lymphoïdes dans les tissus lymphoïdes ont été observées à une exposition (ASC) à la dose minimale ayant un effet observé (DMEO) environ 9 fois supérieure à la dose recommandée chez l'homme (DRH). Ces effets n'étaient pas associés à des signes cliniques d'immunosuppression (par ex., des infections). Des diminutions des numérations plaquettaires et des paramètres de masse des globules rouges ont été observées à une exposition (ASC) à la DMEO environ 42 fois supérieure à la DRH. Dans l'étude de toxicité chronique menée sur des singes, des effets cutanés cliniques et microscopiques, ainsi que des diminutions des paramètres de masse des globules rouges ont été observées à une exposition (ASC) à la DMEO environ 7 fois supérieure à la DRH.
Toxicité pour la reproduction et le développement
Le deucravacitinib n'a pas eu d'effet sur la fertilité ou les premiers stades du développement embryonnaire chez les rats et les rates à des expositions (ASC) jusqu'à 247 et 171 fois supérieures environ à la DRH, respectivement.
Le deucravacitinib n'était ni létal pour les embryons ni tératogène à des expositions maternelles (ASC) jusqu'à 266 fois supérieures environ à la DRH chez les rats ou 91/20 (fraction totale/fraction libre) fois la DRH chez les lapins.
Dans une étude portant sur le développement pré et post-natal chez les rats, des poids temporairement plus faibles des ratons ont été observés pendant la période de pré-sevrage à une exposition maternelle (ASC) environ 110 fois supérieure à la DRH. Cet effet a entièrement disparu après la période de sevrage.
Suite à l'administration de deucravacitinib radiomarqué chez des rates allaitantes, deucravacitinib et/ou ses métabolites étaient présents dans le lait avec des rapports de concentration lait/plasma de 2,7 à 30,9.
DURÉE DE CONSERVATION |
3 ans.
PRÉCAUTIONS PARTICULIÈRES DE CONSERVATION |
Ce médicament ne nécessite pas de précautions particulières de conservation.
PRÉCAUTIONS PARTICULIÈRES D'ÉLIMINATION ET DE MANIPULATION |
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| AMM |
|
| Prix : |
|
Remb Séc soc à 30 % et Collect dans le Traitement du psoriasis en plaques modéré à sévère chez les adultes éligibles à un traitement systémique en cas d'échec, d'intolérance ou de contre-indication aux médicaments biologiques (anti-TNFα et anti-interleukines).
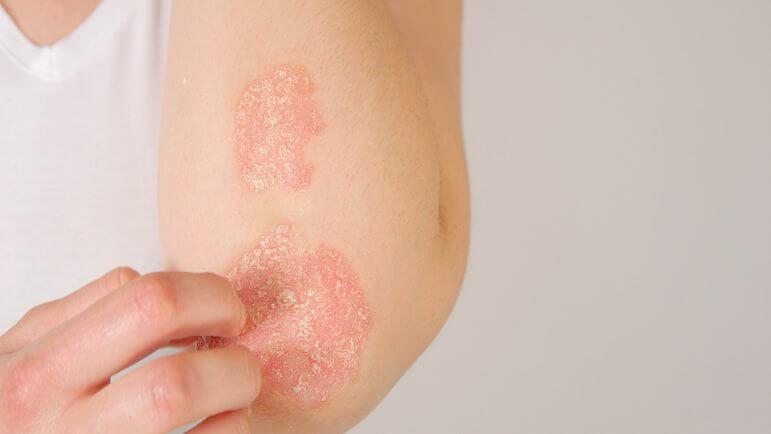
Psoriasis en plaques : SOTYKTU, nouveau traitement systémique par voie orale