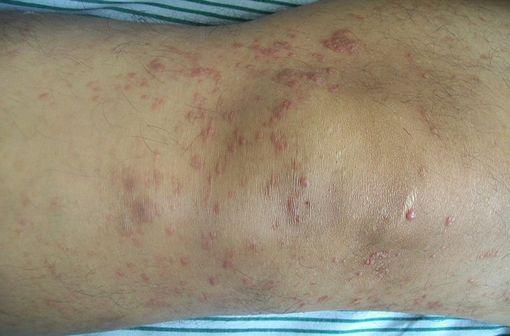
Lésions cutanées de mycosis fongoïde (illustration @Bobjgalindo sur Wikimedia).
POTELIGEO 4 mg/mL solution à diluer pour perfusion (mogalumizumab) est une nouvelle spécialité d'oncologie/hématologie, disponible uniquement à l'hôpital (réservée à l'usage hospitalier).
POTELIGEO est indiqué dans le traitement des patients adultes présentant un mycosis fongoïde (MF) ou un syndrome de Sézary (SS) qui ont reçu au moins un traitement systémique antérieur.
Avant d'obtenir son autorisation de mise sur le marché (AMM), POTELIGEO a bénéficié du régime d'autorisation temporaire d'utilisation (ATU) en France :
- ATU nominative en octobre 2018,
- puis ATU de cohorte débutée le 8 mars 2019.
Le mogamulizumab : nouvel anticorps monoclonal antinéoplasique
Le mogamulizumab est un nouvel anticorps monoclonal. Il s'agit d'une immunoglobuline IgG1 qui se lie sélectivement au CCR4, un récepteur intervenant dans le processus de migration lymphocytaire. Le récepteur CCR4 est exprimé à la surface de certaines cellules tumorales, y compris dans les néoplasies malignes à cellules T telles que le MF et le SS dans lesquels l'expression de CCR4 est inhérente.
Une efficacité comparée à celle du vorinostat (médicament sans AMM en Europe)
L'efficacité et la tolérance du mogamulizumab ont été évaluées dans plusieurs études, dont l'étude de phase III MAVORIC / KW-0761-010 menée versus vorinostat (ZOLINZA - ATU nominative en France).
Les participants à l'étude étaient des patients atteints de lymphome T cutané, avec MF ou SS, et ayant reçu au moins un traitement systémique antérieur.
Cette étude est en faveur d'une efficacité supérieure du mogamulizumab par rapport à celle du vorinostat, en termes de survie sans progression évaluée par l'investigateur (critère de jugement principal) :
- médiane de survie de 7,70 mois (IC95 % [5,67 ; 10,33]) dans le groupe mogamulizumab versus 3,10 mois (IC95 % [2,87 ; 4,07]) dans le groupe vorinostat,
- soit un gain absolu de 4,6 mois en faveur du traitement par mogamulizumab (HR=0,53 (IC95 % [0,41 ; 0,69], p < 0,0001).
Un SMR important selon la CT
La Commission de la Transparence (CT) a procédé à l'évaluation médico-économique de POTELIGEO en 2019.
Dans son avis rendu le 17 juillet 2019, elle attribue à ce médicament, dans l'indication de son AMM :
- un service médical rendu (SMR) important ;
- une amélioration du service médical rendu mineure (ASMR IV).
POTELIGEO en pratique
Chaque flacon de POTELIGEO (5 mL) contient 20 mg de mogamulizumab, soit une concentration de 4 mg/mL. Le solution ne contient pas de conservateur. Un flacon est à usage unique.
POTELIGEO doit être conservé au réfrigérateur (entre 2 °C et 8 °C), dans l'emballage extérieur à l'abri de la lumière.
Après ouverture, le médicament doit être dilué et administré immédiatement. La dilution est réalisée dans une poche à perfusion contenant une solution injectable de chlorure de sodium à 0,9 % (9 mg/mL).
Administration en perfusion intraveineuse, à un rythme hebdomadaire puis toutes les 2 semaines
Le traitement doit être instauré et supervisé par des médecins expérimentés dans les traitements anticancéreux et ne doit être administré que par des professionnels de santé dans un environnement disposant d'un équipement de réanimation.
La dose recommandée est de 1 mg/kg de mogamulizumab.
POTELIGEO est administré en perfusion intraveineuse (IV) d'au moins 60 minutes (en utilisant une ligne intraveineuse munie d'un filtre en ligne stérile à faible liaison aux protéines de 0,22 micron ou équivalent), selon le rythme suivant :
- 1 fois par semaine les jours 1, 8, 15 et 22 du premier cycle de 28 jours,
- puis toutes les 2 semaines les jours 1 et 15 de chaque cycle de 28 jours suivant jusqu'à la progression de la maladie ou la survenue d'une toxicité inacceptable (réaction cutanée, réaction liée à la perfusion, infection grave ou réactivation virale).
Anticiper les événements indésirables : nécessité d'une prémédication
Pour la première perfusion, une prémédication par antipyrétique et antihistaminique est recommandée.
En cas de réaction à la perfusion, une prémédication doit être administrée pour les perfusions suivantes.
Mogamulizumab et virus de l'hépatite B
Un dépistage de l'hépatite B doit être réalisé avant l'instauration du traitement par le mogamulizumab. Pour les patients ayant un résultat positif pour une infection en cours ou antérieure par le virus de l'hépatite B, la consultation d'un médecin expérimenté dans le traitement de l'hépatite B est recommandée.
Identité administrative
- Liste 1
- Réservé à l'usage hospitalier
- Prescription réservée aux spécialistes en hématologie ou en oncologie ou aux médecins compétents en maladies du sang ou en cancérologie
- Surveillance particulière pendant le traitement.
- Boîte de 1 flacon de 5 mL, CIP 3400955060406
- Agrément aux collectivités (Journal officiel du 3 mars 2021 - texte 11)
- Laboratoire Kyowa Kirin
Pour aller plus loin
Arrêté du 23 février 2021 modifiant la liste des spécialités pharmaceutiques agréées à l'usage des collectivités et divers services publics - POTELIGEO (Journal officiel du 3 mars 2021 - texte 11)
Avis de la Commission de la Transparence - POTELIGEO (HAS, 17 juillet 2019)
Pour aller plus loin
Consultez les monographies VIDAL
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 4 minutes
4 minutes Ajouter un commentaire
Ajouter un commentaire




Commentaires
Cliquez ici pour revenir à l'accueil.