
La mucoviscidose est liée à des mutations du gène CFTR sur le chromosome 7.
Dans le traitement de la mucoviscidose, trois arrêtés publiés au Journal officiel du 20 décembre 2022 permettent d'élargir l'utilisation des médicaments modulateurs de la protéine CFTR (Cystic Fibrosis Transmembrane Conductance Regulator) KAFTRIO comprimé pelliculé (ivacaftor/tezacaftor/elexacaftor) et KALYDECO comprimé pelliculé (ivacaftor) en population pédiatrique, chez les enfants de 6 ans et plus porteurs d'au moins une mutation F508del du gène CFTR :
- extension de prise en charge (remboursement, agrément aux collectivités) accordée à KAFTRIO 75 mg/50 mg/100 mg et à KALYDECO 75 mg et 150 mg comprimé. Jusqu'à présent, la prise en charge était limitée aux enfants de 12 ans et plus. Chez l'enfant de 6 à 11 ans, KAFTRIO bénéficiait d'une prise en charge dans le cadre d'une autorisation d'accès précoce depuis le mois de mars 2022 ;
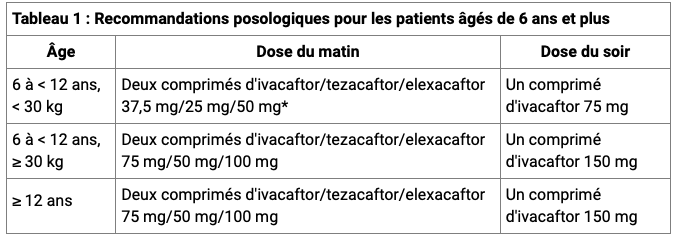
- mise à disposition d'un nouveau dosage de KAFTRIO deux fois moins dosé en principes actifs : KAFTRIO 37,5 mg/25 mg/50 mg. Il correspond à la posologie recommandée chez l’enfant de 6 à moins de 12 ans, et pesant moins de 30 kg.
Une extension de prise en charge (remboursement en ville et agrément aux collectivités) a été accordée aux spécialités KAFTRIO 75 mg/50 mg/100 mg comprimé pelliculé (ivacaftor, tezacaftor, elexacaftor) et KALYDECO 75 mg et 150 mg comprimé pelliculé (ivacaftor) dans le traitement des patients atteints de mucoviscidose âgés de 6 ans et plus porteurs d'au moins une mutation F508del du gène CFTR (cystic fibrosis transmembrane conductance regulator) [1, 2, 3] :
- pour KAFTRIO : le périmètre de prise en charge correspond désormais au traitement, en association avec l'ivacaftor (KALYDECO) des patients atteints de mucoviscidose âgés de 6 ans et plus porteurs d'au moins une mutation F508del du gène CFTR ;
- pour KALYDECO : le périmètre de prise en charge correspond désormais au traitement, en association avec ivacaftor/tezacaftor/elexacaftor (KAFTRIO), des patients atteints de mucoviscidose âgés de 6 ans et plus porteurs d'au moins une mutation F508del du gène CFTR.
Cette double extension de prise en charge est cohérente avec le schéma thérapeutique recommandé, reposant sur la combinaison de KAFTRIO et de KALYDECO.
Pour KAFTRIO comme pour KALYDECO comprimé pelliculé (cf. Encadré), ce nouveau périmètre de prise en charge correspond à l'indication de l'autorisation de mise sur le marché (AMM).
Pour rappel, le remboursement en ville (65 %) est conditionné au respect des règles de prescription applicables à ces médicaments :
- ordonnance de médicament d'exception ;
- prescription initiale hospitalière semestrielle.
Il existe d'autres présentations galéniques de KALYDECO, en granulés en sachet (25 mg, 50 mg et 75 mg), disposant d'autres indications. |
Évaluation médico-économique de KAFTRIO/KALYDECO chez l'enfant de 6 à 11 ans
KAFTRIO et KALYDECO ont reçu une extension d'AMM accordée pour le traitement de l'enfant de 6 à 11 ans en janvier 2022.
Pour accélérer l'accès à ce traitement sans attendre les arrêtés de prise en charge, une autorisation d'accès précoce a été accordée à KAFTRIO/KALYDECO en mars 2022 dans l'indication suivante :
- traitement des patients atteints de mucoviscidose âgés de 6 à 11 ans hétérozygotes pour la mutation F508del du gène CFTR et porteurs d'une mutation du gène CFTR à fonction minimale.
Les patients homozygotes étaient donc exclus de ce dispositif d'accès précoce.
ASMR mineure ou importante selon le profil des patients
La Commission de la transparence (CT) a examiné la demande de prise en charge de KAFTRIO/KALYDECO dans la tranche d'âge 6-11 ans en mai 2022 [4]. Elle a attribué à KAFTRIO/KALYDECO :
- un service médical rendu (SMR) important dans cette tranche d'âge ;
- des niveaux d'amélioration de service médical rendu (ASMR) différents selon le profil des patients :
- ASMR importante (niveau II) pour les patients homozygotes pour la mutation F508del du gène CFTR ou hétérozygotes pour la mutation F508del du gène CFTR et porteurs d’une mutation du gène CFTR à fonction minimale,
- ASMR mineure (niveau IV) pour les patients âgés de 6 à 11 ans hétérozygotes pour la mutation F508del du gène CFTR et porteurs d’une mutation à fonction résiduelle ou d’une mutation dite « gating ».
La CT a pris en compte :
- la démonstration de la supériorité de KAFTRIO/KALYDECO par rapport au placebo (étude de phase IIIb VX19-445-116 [NTC04353817] ou étude 116, randomisée, contrôlée versus placebo), en termes de variation absolue de l'indice de clairance pulmonaire ICP2,5 moyenne jusqu'à la semaine 24 : différence de -2,26 points (IC95% [-2,71 ; -1,81], p < 0,0001) chez les patients de 6 à 11 ans hétérozygotes pour la mutation F508del du gène CFTR et porteurs d'une mutation du gène CFTR à fonction minimale ;
- les résultats d'une étude de phase III non comparative et de son extension dont les résultats suggèrent une efficacité de KAFTRIO/KALYDECO sur le volume maximal expiré par seconde (VEMS) maintenue sur le long terme chez des enfants de 6 à 11 ans homozygotes pour la mutation F508del ou hétérozygotes pour la mutation F508del du gène CFTR et porteurs d'une mutation du gène CFTR à fonction minimale.
Une place de référence dans la stratégie thérapeutique
Dans la stratégie thérapeutique, la CT considère que la place de l'association KAFTRIO/KALYDECO est celle d'un traitement de fond, de première intention, qui doit être prescrit d'emblée aux patients âgés de 6 ans et plus atteints de mucoviscidose porteurs d'au moins une mutation F508del du gène CFTR.
Elle rappelle que « la prise en charge des patients atteints de mucoviscidose nécessite l'intervention d'une équipe pluridisciplinaire (centres de ressources et de compétences de la mucoviscidose, médecin traitant, centres spécialisés, équipe paramédicale avec kinésithérapeute et infirmière) ».
Un nouveau dosage de KAFTRIO pour satisfaire les recommandations posologiques chez l'enfant de 6 à 11 ans
En parallèle de ces extensions de prise en charge, un nouveau dosage de KAFTRIO moins dosé en principes actifs (37,5 mg d'ivacaftor, 25 mg de tezacaftor, 50 mg d'elexacaftor) est mis à disposition sur le marché français pour compléter les recommandations posologiques chez l'enfant (cf. Tableau ci-dessous).
Ce dosage est adapté à l'enfant de 6 à moins de 12 ans, pesant moins de 30 kg.
Identité administrative de KAFTRIO 37,5 mg/25 mg/50 mg comprimé pelliculé
Liste I
Prescription initiale hospitalière semestrielle
Renouvellement non restreint
Boîte de 56, CIP 3400930242797
Remboursable à 65 % sur ordonnance de médicament d'exception [1]
Prix public TTC = 10 158,27 euros
Agrément aux collectivités [3]
Laboratoire Vertex Pharmaceuticals
[1] Arrêté du 14 décembre 2022 modifiant la liste des spécialités pharmaceutiques remboursables aux assurés sociaux - Fiche d'information thérapeutique de KAFTRIO (Journal officiel du 20 décembre 2022 - texte 24)
[2] Arrêté du 14 décembre 2022 modifiant la liste des spécialités pharmaceutiques remboursables aux assurés sociaux - Fiche d'information thérapeutique de KALYDECO (Journal officiel du 20 décembre 2022 - texte 25)
[3] Arrêté du 14 décembre 2022 modifiant la liste des spécialités pharmaceutiques agréées à l'usage des collectivités et divers services publics - KAFTRIO et KALYDECO (Journal officiel du 20 décembre 2022 - texte 26)
[4] Avis de la Commission de la transparence - KAFTRIO et KALYDECO chez l'enfant de 6 ans et plus (HAS, 11 mai 2022)

 6 minutes
6 minutes Ajouter un commentaire
Ajouter un commentaire






Commentaires
Cliquez ici pour revenir à l'accueil.