Estimer la probabilité d'une relation entre un médicament et un effet indésirable.
Parmi les missions du système de pharmacovigilance, il est une très spécifique : l’évaluation de l’imputabilité d’un médicament dans la survenue d’un effet indésirable. Autrement dit, il s’agit d’apprécier dans quelle mesure le médicament est impliqué dans cet événement.
L’association d’un médicament et d’un effet indésirable ne signe en effet pas forcément une relation causale.
Plusieurs méthodes peuvent être utilisées pour permettre de révéler et de coter l’imputabilité. La version de 1985 de la méthode dite française est celle qui est obligatoirement utilisée par les centres régionaux de pharmacovigilance et les laboratoires pharmaceutiques.
Ce nouveau chapitre complète les actualités VIDAL précédentes ayant dressé un bref portrait de la pharmacovigilance puis détaillé son organisation en France. Il sera suivi d’un dernier article qui aura trait à la pharmaco-épidémiologie, aux enquêtes de pharmacovigilance et à la communication sur la sécurité des médicaments.
Les abréviations utilisées sont listées à la fin de l’article.
L’évaluation de l’imputabilité, c’est-à-dire de la force qualitative du lien éventuel entre un événement indésirable et un ou des médicaments, fait appel à des outils qui permettent aux autorités de santé, aux spécialistes de pharmacovigilance, aux laboratoires pharmaceutiques, aux auteurs de publications d’utiliser un langage commun.
Les différentes méthodes
Il existe plusieurs méthodes pour permettre d’apprécier l’imputabilité médicamenteuse.
- La méthode dite française [1] actualisée en 1985 et 2011.
La version de 1985 [2] est celle qui est officielle et obligatoire pour les centres régionaux de pharmacovigilance (CRPV) français et les laboratoires pharmaceutiques. Elle permet de qualifier le rôle du médicament dans la survenue d’un effet indésirable (EI) d’« incompatible » à « très vraisemblable », selon des critères d’analyse chronologique et sémiologique.
- La méthode de Naranjo [3], très employée aux États-Unis et au Canada (notamment pour les publications).
Elle permet de quantifier le rôle du médicament dans l’apparition d’un EI grâce à un score transformé en adjectif :- score ≤ 0 : douteux ;
- entre 1 et 4 : possible ;
- entre 5 et 8 ; probable ;
- score ≥ 9 : certain.
- La méthode de l’Organisation mondiale de la santé existe depuis 1987 et elle est utilisée par 75 % des pays du monde. Elle ne prend pas en compte le critère bibliographique. Le rôle du médicament est considéré comme : « improbable » ; « possible » ; « probable » ; « certain ».
Aux États-Unis, les méthodes d’imputabilité sont abandonnées au profit de l’enregistrement systématique de tous les événements indésirables médicamenteux (EIM notifiés, data mining) de façon à générer automatiquement des signaux (nouveauté, gravité, etc.).
Détails de la méthode dite française
Établir l’imputabilité nécessite une analyse rigoureuse d’une situation médicale, avec ses composantes diagnostique, étiologique, aboutissant à une conduite à tenir.
La méthode dite française distingue l’imputabilité intrinsèque (critères chronologiques et sémiologiques) de l’imputabilité extrinsèque (critère bibliographique).
- Sur le plan individuel, cette analyse vise à établir un diagnostic pour un patient donné avec à la clé une conduite à tenir : arrêt du médicament ? Réadministration ou non ? etc. Elle ne peut cependant se substituer au raisonnement pharmaco-clinique qui permet, devant un EI, de conseiller, chez un patient en particulier, la conduite à tenir la plus adaptée.
- Sur le plan populationnel, l’imputabilité participe à l’étude du potentiel de dangerosité du médicament dans l’absolu et permet l’adoption d’un langage commun entre les autorités de santé, les spécialistes de pharmacovigilance et les laboratoires pharmaceutiques.
L’imputabilité intrinsèque
L'imputabilité intrinsèque est déterminée par un score chronologique et un score sémiologique.
Le score chronologique
Le score chronologique évalue :
- le délai de survenue de l'EI par rapport à l'exposition médicamenteuse, qui est qualifié de « suggestif » (« très suggestif » dans la méthode de 1985), « compatible » ou « incompatible ».
Par exemple, ce délai est (cf. Tableau I) :
- (très) suggestif en cas de choc anaphylactique survenant immédiatement après l'administration par voie IV d'un médicament (un quart d'heure à une demi-heure après prise orale) ;
- incompatible : en cas de cancer ou de cirrhose quelques jours après la prise d'un médicament ou de médicament pris après la survenue de l'EI ;
- compatible : dans les autres situations. - l'évolution de l'EI à l'arrêt de l'exposition qui peut être suggestive, non concluante ou non suggestive.
- la récidive ou non en cas de réadministration (rechallenge) du produit :
- R(+) : Rechallenge positif ;
- R(0) : Rechallenge non fait ;
- R(-) : Rechallenge négatif.
Selon les résultats, le score d’imputabilité chronologique (cf. Tableau I) est coté : « vraisemblable » (C3) ; « plausible » (C2) ; « douteux » (C1) ; « incompatible » (C0).
Tableau I - Table de décision combinant les critères chronologiques (C)
dans la méthode française d’imputabilité réactualisée de 2011 [4]
Le score sémiologique
Le score sémiologique (« vraisemblable » : S3 ; « plausible » : S2 ; « douteux » : S1) est établi en fonction de l'existence ou non d'une étiologie non médicamenteuse, du mécanisme d'action du médicament pouvant expliquer ou non l'EI et de la présence ou non d'éventuels facteurs favorisants (cf. Tableau II).
Tableau II - Table de décision combinant les critères sémiologiques (S)
dans la méthode d’imputabilité française réactualisée de 2011 [4]
Au total, en combinant critère chronologique (C) et sémiologique (S), l'imputabilité intrinsèque est cotée : « très vraisemblable » (I4) ; « vraisemblable » (I3) ; « plausible » (I2) ; « douteuse » (I1) ; paraissant exclue (I0) (cf. Tableau III).
Tableau III - Score d’imputabilité intrinsèque de la méthode française d’imputabilité de 1985
à partir de la combinaison des scores chronologiques (C) et sémiologiques (S) [4] 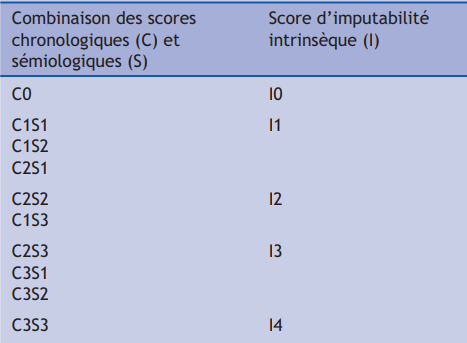
L’imputabilité extrinsèque
L’imputabilité extrinsèque est estimée à partir de cas similaires trouvés dans la littérature médicale. Elle est donc déterminée sur des critères bibliographiques.
[3] Naranjo CA et al. A method for estimating the probability of adverse drug reaction. Clin Pharmacol Ther., 1981; 30: 239-245. doi: 10.1038/clpt.1981.154
[4] Miremont-Salamé G et al. Imputabilité en pharmacovigilance : de la méthode française originelle aux méthodes réactualisées. Therapies, 2016; 71; 2 :171-178. doi : 10.1016/j.therap.2016.02.009
|
Glossaire AMM : autorisation de mise sur le marché ANSM : Agence nationale de sécurité des médicaments ARS : agence régionale de santé BNPV : base nationale de pharmacovigilance CAP-TV : centres antipoison et de toxicovigilance CEIP-A : centres d'évaluation et d'information sur la pharmacodépendance-addictovigilance CRPV : centres régionaux de pharmacovigilance EI : effet indésirable EIM : effet indésirable d’un médicament EMA : Agence européenne des médicaments EPI-PHARE : Groupe d’intérêt scientifique créé par l’ANSM et la Cnam EudraVigilance : Base de données européenne de pharmacovigilance OMS : Organisation mondiale de la santé PRAC : Pharmacovigilance Risk Assessment Committee PV : pharmacovigilance RREVA : Réseau régional de vigilance et d’appui SNDS : Système national des données de santé VigiBase : Base internationale de pharmacovigilance pilotée par l’OMS |

 5 minutes
5 minutes Ajouter un commentaire
Ajouter un commentaire





Commentaires
Cliquez ici pour revenir à l'accueil.