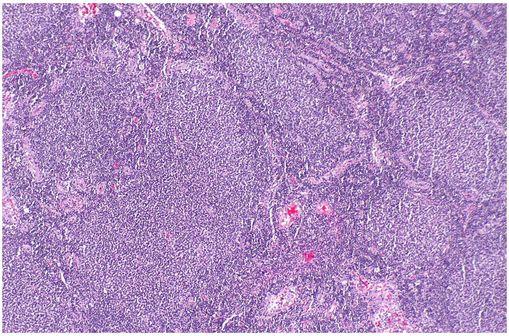
Micrographie montrant un lymphome à cellules B, compatible avec un lymphome folliculaire (illustration @Nephron, sur Wikimedia).
La prise en charge (agrément aux collectivités et rétrocession) de REVLIMID gélule (lénalidomide) est étendue, en association au rituximab, au traitement du lymphome folliculaire (de grade 1, 2 ou 3a) préalablement traité chez les patients adultes non réfractaires au rituximab.
Malgré la démonstration de la supériorité de l'association lénalidomide/rituximab par rapport au rituximab seul en termes de survie sans progression (critère de jugement principal), avec un gain médian de + 25,3 mois (HR = 0,46 ; IC95 % [0,34- 0,62]), le service médical rendu (SMR) de REVLIMID est jugé faible et l'amélioration du SMR absente (ASMR V). Dans son avis du 23 septembre 2020, la Commission de la Transparence a tenu compte notamment de l'absence de démonstration d'un bénéfice en termes de survie globale et d'un impact sur la qualité de vie, mais aussi des réserves sur le bien-fondé du choix du comparateur (rituximab en monothérapie) qui ne permet pas d'assurer la transposabilité des résultats de cette étude à la pratique française.
À noter que le périmètre de prise en charge de REVLIMID dans le lymphome folliculaire est restreint par rapport à celui de l'autorisation de mise sur le marché (SMR) puisqu'il ne concerne que les patients non préalablement traités par rituximab ou qui n'ont pas rechuté sous traitement incluant le rituximab ou dans les 6 mois suivant son arrêt.
- en association avec le rituximab pour le traitement du lymphome folliculaire (de grade 1, 2 ou 3a) préalablement traité chez les patients adultes non-réfractaires au rituximab (patients non préalablement traités par rituximab ou qui n'ont pas rechuté sous traitement incluant le rituximab ou dans les 6 mois suivant son arrêt).
Un périmètre de prise en charge restreint par rapport à l'indication de l'AMM
Comme demandé par le laboratoire, l'indication nouvellement remboursable dans le lymphome folliculaire est restreinte par rapport à l'indication de l'autorisation de mise sur le marché (AMM - cf. Encadré 1) octroyée en décembre 2019 par l'Agence européenne du médicament (EMA).
Le périmètre de prise en charge n'inclut que les patients adultes non-réfractaires au rituximab (patients non préalablement traités par rituximab ou qui n'ont pas rechuté sous traitement incluant le rituximab ou dans les 6 mois suivant son arrêt) alors que l'indication de l'AMM inclut tous les patients adultes préalablement traités.
Myélome multiple (cf. VIDAL Reco "Myélome multiple") :
Syndromes myélodysplasiques :
Lymphome à cellules du manteau :
Lymphome folliculaire :
|
Évaluation médico-économique : un SMR faible, sans ASMR
La Commission de la Transparence (CT) a rendu un avis favorable pour la prise en charge de REVLIMID dans le traitement du lymphome folliculaire, avec un service médical rendu (SMR) faible et sans amélioration du service médical rendu (ASMR V).
La CT a examiné les résultats de deux études ayant évalué l'efficacité et la tolérance de REVLIMID dans cette indication :
- l'étude de phase III (AUGMENT) [1] contrôlée versus placebo, dont l'objectif principal était de démontrer la supériorité de REVLIMID + rituximab (lénalidomide) par rapport au placebo + rituximab pour une durée maximum de 12 cycles de 28 jours, en termes de survie sans progression (SSP) ;
- l'étude de phase IIIb (MAGNIFY) [2], comportant une phase initiale de traitement non comparative par REVLIMID + rituximab pendant 12 cycles de 28 jours (résultats disponibles issus d'une analyse intermédiaire), puis une phase d'extension comparant REVLIMID + rituximab versus rituximab seul.
Ces études démontrent la supériorité de l'association lénalidomide/rituximab par rapport au rituximab administré seul, pendant une durée maximum de 12 cycles de 28 jours, en termes de survie sans progression (critère de jugement principal), avec un gain médian de + 25,3 mois (HR = 0,46 ; IC95 % [0,34- 0,62]).
Malgré cette démonstration de supériorité, la CT estime que le rapport efficacité/effets indésirables dans cette indication est faible, en raison :
- de l'absence de démonstration d'un bénéfice en termes de survie globale, critère secondaire exploratoire de l'étude considéré comme plus cliniquement pertinent que la survie sans progression dans le lymphome folliculaire en rechute,
- des réserves sur le bien-fondé du choix du comparateur (rituximab en monothérapie) qui ne permet pas d'assurer la transposabilité des résultats de cette étude à la pratique française, "en particulier pour les patients pour lesquels une chimiothérapie de type CHOP [NDLR : cyclophosphamide, vincristine et prednisone], bendamustine ou CVP [NDLR : cyclophosphamide, vincristine et prednisone] est réalisable (qui représentaient 71% des patients de l'étude)",
- de l'absence d'impact démontré sur la qualité de vie.
REVLIMID dans le traitement du lymphome folliculaire : en pratique
La prescription de REVLIMID (prescription hospitalière) est réservée aux spécialistes en oncologie ou en hématologie, ou aux médecins compétents en cancérologie ou en maladies du sang.
Le traitement par le lénalidomide ne doit pas être initié si la numération des polynucléaires neutrophiles (PNN) est < 1 x 109/L et/ou si la numération plaquettaire est < 50 x 109/L, à moins que ces diminutions soient secondaires à un envahissement médullaire induites par le lymphome.
Posologie de REVLIMID
La posologie initiale recommandée de REVLIMID (lénalidomide) dans cette indication est de 20 mg par voie orale sur 21 jours par cycle de 28 jours, pendant 12 cycles de traitement au maximum.
Le lénalidomide est associé au rituximab à raison de 375 mg/m2 par voie intraveineuse chaque semaine au cours du cycle 1 (J1, J8, J15, J22) et le jour 1 de chaque cycle de 28 jours pendant les cycles 2 à 5.
Pour aller plus loin
Arrêté du 28 mai 2021 modifiant la liste des spécialités pharmaceutiques agréées à l'usage des collectivités et divers services publics - REVLIMID (Journal officiel du 4 juin 2021, texte 21)
Arrêté du 28 mai 2021 relatif aux conditions de prise en charge de spécialités pharmaceutiques disposant d'une autorisation de mise sur le marché inscrites sur la liste visée à l'article L. 5126-6 du code de la santé publique - REVLIMID (Journal officiel du 4 juin 2021 - texte 22)
Avis de la Commission de la Transparence - REVLIMID (HAS, 23 septembre 2020)
Les études pivots :
(1) Leonard JP et Coll. AUGMENT Trial Investigators. AUGMENT : A Phase III Study of Lenalidomide Plus Rituximab Versus Placebo Plus Rituximab in Relapsed or Refractory Indolent Lymphoma. J Clin Oncol 2019 May ; 37(14) : 1188-99
(2) Andorsky DJ et Coll. MAGNIFY : Phase IIIb Randomized Study of Lenalidomide Plus Rituximab (R2) Followed By Lenalidomide Vs. Rituximab Maintenance in Subjects with Relapsed/Refractory Follicular, Marginal Zone, or Mantle Cell Lymphoma. Blood 2016 ; 128 (22): 1798 (abstract)

 5 minutes
5 minutes Ajouter un commentaire
Ajouter un commentaire




Commentaires
Cliquez ici pour revenir à l'accueil.