Globule rouge falciforme (pâle, en haut), typique de la drépanocytose (illustration @OpenStax College - Anatomy & Physiology, sur Wikimedia)
Résumé :
ADAKVEO 10 mg/mL solution à diluer pour perfusion (crizanlizumab) est une nouvelle spécialité, réservée à l'usage hospitalier, indiquée dans la prévention des crises vaso-occlusives (CVO) récurrentes chez les patients atteints de drépanocytose âgés de 16 ans et plus.
Son principe actif, le crizanlizumab, est un nouvel anticorps monoclonal : il agit en bloquant la P-sélectine, molécule intervenant dans les mécanismes de vaso-occlusion et de crises vaso-occlusives, et sur-exprimée chez les personnes atteintes de drépanocytose.
ADAKVEO se présente en solution à diluer, en flacon de 10 mL (100 mg de crizanlizumab). La dose recommandée est de 5 mg/kg, administrée en perfusion intraveineuse de 30 minutes, en semaines 0 et 2, puis toutes les 4 semaines.
ADAKVEO peut être administré seul ou en association avec l'hydroxyurée/hydroxycarbamide (HU/HC).
ADAKVEO est agréé aux collectivités. Sa prescription est réservée à certains spécialistes.
ADAKVEO 10 mg/mL solution à diluer pour perfusion (crizanlizumab) est une nouvelle spécialité, réservée à l'usage hospitalier, indiquée dans la prévention des crises vaso-occlusives (CVO) récurrentes chez les patients atteints de drépanocytose âgés de 16 ans et plus.
Son principe actif, le crizanlizumab, est un nouvel anticorps monoclonal : il agit en bloquant la P-sélectine, molécule intervenant dans les mécanismes de vaso-occlusion et de crises vaso-occlusives, et sur-exprimée chez les personnes atteintes de drépanocytose.
ADAKVEO se présente en solution à diluer, en flacon de 10 mL (100 mg de crizanlizumab). La dose recommandée est de 5 mg/kg, administrée en perfusion intraveineuse de 30 minutes, en semaines 0 et 2, puis toutes les 4 semaines.
ADAKVEO peut être administré seul ou en association avec l'hydroxyurée/hydroxycarbamide (HU/HC).
ADAKVEO est agréé aux collectivités. Sa prescription est réservée à certains spécialistes.
Une nouvelle spécialité est mise à disposition en France, à l'hôpital, dans la prise en charge des patients drépanocytaires : ADAKVEO 10 mg/mL solution à diluer pour perfusion (crizanlizumab).
ADAKVEO est indiqué dans la prévention des crises vaso-occlusives (CVO) récurrentes chez les patients atteints de drépanocytose âgés de 16 ans et plus. Il peut être administré :
- en association avec de l'hydroxyurée/de l'hydroxycarbamide (HU/HC)
- ou en monothérapie chez les patients chez qui le traitement par HU/HC est inapproprié ou inadéquat.
Avant d'être commercialisé en France, le crizanlizumab a été mis à disposition sous le statut d'autorisation temporaire d'utilisation (ATU), nominative (2019) puis de cohorte (2020).
L'Agence européenne du médicament (EMA) a accordé à ADAKVEO une autorisation de mise sur le marché (AMM) conditionnelle en octobre 2020, en tant que médicament orphelin. L'EMA attend notamment des données supplémentaires de sécurité et d'efficacité pour confirmer l'AMM.
ADAKVEO fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de santé déclarent tout effet indésirable suspecté.
Le crizanlizumab, nouvel anticorps monoclonal
ADAKVEO est la première spécialité à base de crizanlizumab disponible en France.
Cet anticorps monoclonal (AcM) humanisé IgG2 kappa appartient à une nouvelle classe pharmaco-thérapeutique d'inhibiteurs de la P-sélectine.
La P-sélectine est une molécule d'adhésion exprimée sur les cellules endothéliales activées et les plaquettes. Elle joue un rôle essentiel dans le recrutement initial des leucocytes et l'agrégation des plaquettes sur le site de la lésion vasculaire pendant l'inflammation.
Elle est présente à des taux élevés chez les patients atteints de drépanocytose, avec une sur-expression au cours de l'état pro-inflammatoire chronique associé à la drépanocytose. Cette molécule joue un rôle dans l'agglutination des vaisseaux lors des crises vaso-occlusives.
En se fixant à la P-sélectine à la surface des cellules endothéliales activées et des plaquettes, le crizanlizumab bloque efficacement les interactions entre les cellules endothéliales, les plaquettes, les globules rouges et les leucocytes, prévenant ainsi la vaso-occlusion.
Évaluation de l'efficacité du crizanlizumab sur la survenue de CVO
L'AMM d'ADAKVEO (crizanlizumab) repose principalement sur l'étude clinique de phase II SUSTAIN (1, 2), d'une durée de 52 semaines, randomisée, contrôlée versus placebo, en double aveugle, multicentrique, conduite chez des patients, âgés de 16 ans et plus, atteints de drépanocytose (quel que soit le génotype, HbSS, HbSC, HbSß0 , HbSß+, ou autre), présentant des antécédents de CVO récurrentes.
L'efficacité clinique et le profil de tolérance du crizanlizumab ont été évalués aux posologies de 5 mg/kg et de 2,5 mg/kg (posologie hors AMM) [cf. Figure 1].
Le critère principal de jugement était le taux annuel de CVO liées à la drépanocytose (définies par un épisode aigu de douleur n'ayant aucune autre cause qu'un événement vaso-occlusif nécessitant une visite dans un centre médical et un traitement oral ou parentéral par opiacés/parentéral par anti-inflammatoires non stéroïdiens), évalué sur la population ITT (n = 198).
Figure 1 - Schéma de l'étude SUSTAIN

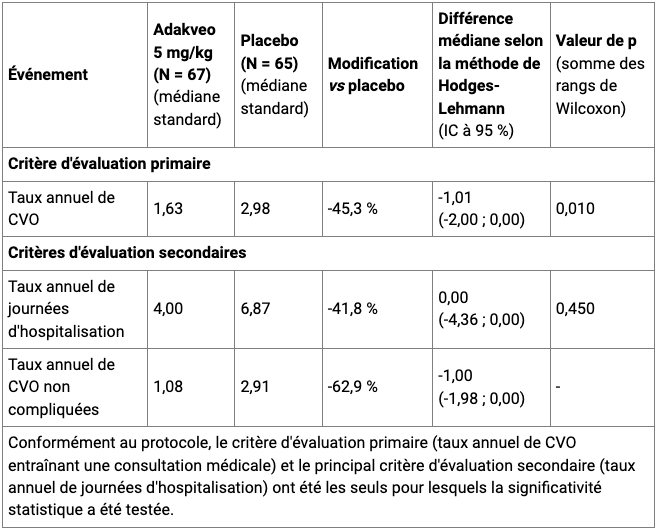
Selon les résultats de cette étude (cf. Tableau I), le taux annuel médian de CVO dans le groupe crizanlizumab 5,0 mg/kg a été plus faible de 1,35 crises par an, soit une réduction du taux annuel de crises de 45,3 % versus placebo (différence des médianes selon la méthode de Hodges-Lehmann de -1,01, IC95 % [-2,00 ; 0,00]), p = 0,010)
Tableau I - Principaux résultats de l'étude clinique SUSTAIN dans la drépanocytose
Évaluation médico-économique : la CT conclut à un SMR faible
La demande de prise en charge d'ADAKVEO (agrément aux collectivités) a fait l'objet d'un avis de la Commission de la Transparence (CT) en mai 2021 (avis du 5 mai 2021) selon lequel, sur la base des données disponibles, elle estime qu'ADAKVEO apporte un service médical rendu (SMR) faible, sans amélioration du SMR (ASMR V).
La CT qualifie de modeste l'efficacité démontrée dans l'étude de phase II SUSTAIN (réduction du taux annuel médian de CVO de 1,35 crises par an avec le crizanlizumab par rapport au placebo). Elle souligne par ailleurs l'impossibilité d'estimer la quantité d'effet du crizanlizumab d'une part en monothérapie chez les patients pour lesquels le traitement par hydroxycarbamide est inapproprié ou inadéquat, et d'autre part en association avec l'hydroxycarbamide, liée à l'hétérogénéité de la population incluse. Elle tient également compte du faible recul en termes d'efficacité et de tolérance (1 an). Enfin, elle regrette l'absence de données comparant le crizanlizumab et le traitement de référence par hydroxycarbamide.
Ce SMR est conditionné à la réévaluation d'ADAKVEO dans un délai maximal de 4 ans, sur la base notamment :
- des résultats de l'étude de phase III STAND (A2301) versus placebo, comparant l'efficacité et la tolérance du crizanlizumab aux doses de 5,0 mg/kg ou 7,5 mg/kg (posologie hors AMM), chez des patients âgés de 12 ans et plus atteints de drépanocytose et ayant rapporté au moins 2 crises vaso- occlusives (sans limite supérieure) entrainant une consultation médicale au cours des 12 derniers mois, avec un objectif de 240 patients inclus (résultats intermédiaires attendus en 2025) ;
- de la mise en place d'un registre national exhaustif recensant tous les patients atteints de drépanocytose traités par crizanlizumab en France, devant décrire ls caractéristiques cliniques des patients, leur évolution clinique, les effets indésirables/secondaires, et la la place d'ADAKVEO dans la stratégie thérapeutique.
En conclusion de son avis, la CT considère qu'"un traitement par crizanlizumab doit être envisagé préférentiellement en association à l'hydroxycarbamide. Toutefois, le crizanlizumab, selon son RCP, pourra être prescrit en monothérapie uniquement chez les patients chez qui le traitement par hydroxycarbamide est inapproprié ou inadéquat". Ce besoin médical n'était pas couvert par l'arsenal thérapeutique jusque là disponible.
ADAKVEO en pratique
Le traitement par ADAKVEO doit être initié par un médecin expérimenté dans la prise en charge de la drépanocytose.
ADAKVEO se présente en solution à diluer, conditionnée par flacon de 10 mL (soit 100 mg de crizanlizumab par flacon).
Avant la perfusion, ADAKVEO doit être dilué avec une solution de chlorure de sodium à 9 mg/mL (0,9 %) solution pour injection ou de glucose à 5 %.
Avant dilution, le flacon doit être conservé au réfrigérateur (entre 2 °C et 8 °C), dans l'emballage extérieur à l'abri de la lumière.
Dose et fréquence d'administration
La dose recommandée de crizanlizumab est de 5 mg/kg administrés sur une période de 30 minutes par perfusion intraveineuse (IV) à travers un filtre en ligne de 0,2 micron stérile :
- à la semaine 0,
- à la semaine 2,
- puis toutes les 4 semaines.
ADAKVEO peut être administré seul ou en association avec de l'HU/HC.
En cas de réactions liées à la perfusion, et selon la sévérité de l'effet indésirable, il est recommandé :
- d'interrompre temporairement ou d'interrompre totalement la perfusion, ou de réduire le débit de perfusion,
- d'initier un traitement symptomatique (antipyrétique, analgésique et/ou antihistaminique par exemple).
Si le traitement est maintenu, un traitement préventif et/ou un débit de perfusion plus lent doivent être prévus lors des perfusions suivantes.
Identité administrative
- Liste I
- Médicament réservé à l'usage hospitalier
- Prescription réservée aux spécialistes en hématologie, ou en médecine interne ou aux médecins compétents en maladies du sang
- Flacon de 10 mL, CIP 3400955075530
- Agrément aux collectivités (Journal officiel du 29 octobre 2021 - texte 30)
- Laboratoire Novartis Pharma
Pour aller plus loin
Avis de la Commission de la Transparence - ADAKVEO (HAS, 5 mai 2021)
Les études pivots
(1) Ataga KI, Kutlar A, Kanter J et al. Crizanlizumab for the Prevention of Pain Crises in Sickle Cell Disease. N Engl J Med. 2017 Feb 2 ; 376(5) : 429-439.
(2) Kutlar A, Kanter J, Liles DK et al. Effect of crizanlizumab on pain crises in subgroups of patients with sickle cell disease: A SUSTAIN study analysis. Am J Hematol. 2019 Jan ; 94(1) : 55-61.
Pour aller plus loin
Consultez les monographies VIDAL
Sources
Pour recevoir gratuitement toute l’actualité par mail Je m'abonne !

 6 minutes
6 minutes Ajouter un commentaire
Ajouter un commentaire






Commentaires
Cliquez ici pour revenir à l'accueil.