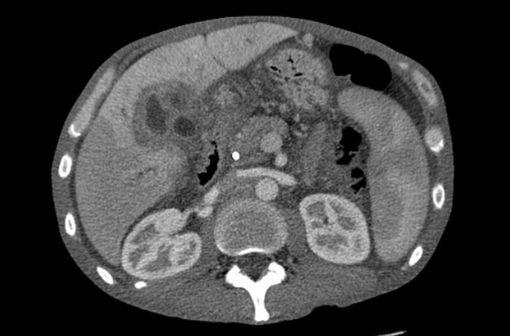
Tomodensitométrie montrant un cholangiocarcinome (illustration @Samir, Wikimedia).
PEMAZYRE est un médicament anticancéreux per os indiqué en monothérapie pour le traitement des adultes atteints d’un cholangiocarcinome localement avancé ou métastatique avec fusion ou réarrangement du gène du récepteur 2 du facteur de croissance des fibroblastes (FGFR2), dont la maladie a progressé après au moins une ligne de traitement systémique antérieure.
Le principe actif de PEMAZYRE, le pemigatinib, est un inhibiteur de kinases de FGFR1, 2 et 3 (facteurs de croissance des fibroblastes).
La gamme se décline sous trois dosages : 4,5 mg, 9 mg et 13,5 mg et se présente sous forme de comprimés.
Le schéma posologique correspond à des cycles de 21 jours comportant 14 jours consécutifs de traitement, 7 jours d'arrêt.
Le traitement est initié à la dose de 13,5 mg de pemigatinib 1 fois par jour. Cette dose doit être réduite en cas d'événements indésirables (hyperphosphatémie, toxicité oculaire), ou en cas d'utilisation inévitable avec certains médicaments (inhibiteurs puissants du CYP3A4).
La phosphatémie doit être étroitement surveillée et des mesures d'appoint (régime pauvre en phosphates, traitement visant à réduire les phosphates sériques) sont recommandées en cas d'hyperphosphatémie pendant le traitement.
Les conseils suivants doivent être donnés aux patients :
- éviter de consommer du pamplemousse ou du jus de pamplemousse ;
- suivre une contraception efficace féminine et masculine. Un test de grossesse doit être réalisé avant l'initiation du traitement.
PEMAZYRE est soumis à prescription hospitalière, réservée aux spécialistes en oncologie ou aux médecins compétents en cancérologie.
Ce médicament est disponible à l'hôpital et en ville, avec un remboursement intégral (100 %) dans une indication restreinte correspondant à un sous-groupe de patients atteints d'un cholangiocarcinome intrahépatique localement avancé ou métastatique avec fusion ou réarrangement du gène du récepteur 2 du facteur de croissance des fibroblastes (FGFR2) qui ont progressé après au moins une ligne de traitement systémique et non éligibles à une chimiothérapie par FOLFOX.
Quel que soit le dosage, PEMAZYRE est conditionné en boîte de 14, et le prix public est fixé à 6 448,38 euros TTC.
Antinéoplasique à base de pemigatinib, PEMAZYRE comprimé est indiqué en monothérapie pour le traitement des adultes atteints d'un cholangiocarcinome localement avancé ou métastatique avec fusion ou réarrangement du gène du récepteur 2 du facteur de croissance des fibroblastes (FGFR2), dont la maladie a progressé après au moins une ligne de traitement systémique antérieure.
Il est disponible sous trois dosages :
Pour rappel, le cholangiocarcinome est un cancer des voies biliaires. Cette tumeur rare touche environ 2 000 personnes en France chaque année.
Le pemigatinib est un inhibiteur de kinases de FGFR1, 2 et 3 (facteurs de croissance des fibroblastes). Son mode d'action repose sur le blocage de l'activité des récepteurs de FGFR anormaux localisés à la surface des cellules cancéreuses.
PEMAZYRE fait l'objet d'une surveillance supplémentaire qui permettra l'identification rapide de nouvelles informations relatives à la sécurité. Les professionnels de la santé déclarent tout effet indésirable suspecté.
SMR faible dans une indication restreinte
Avant de recevoir son autorisation de mise sur le marché (AMM) conditionnelle, le pemigatinib a fait l'objet en France d'une autorisation temporaire d'utilisation (ATU) nominative puis d'une ATU de cohorte, respectivement en 2020 puis 2021.
Ayant examiné la demande de prise en charge de PEMAZYRE en 2021, la Commission de la transparence (CT) a rendu un avis le 21 juillet 2021 [1] où elle attribue à PEMAZYRE :
- un service médical rendu (SMR) faible dans le sous-groupe de patients atteints d’un cholangiocarcinome intrahépatique localement avancé ou métastatique avec fusion ou réarrangement du récepteur 2 du facteur de croissance des fibroblastes (FGFR2) qui sont en rechute ou réfractaires après au moins une ligne de traitement systémique, non éligibles à une chimiothérapie par FOLFOX. Dans cette indication, la CT considère que PEMAZYRE n'apporte pas d'amélioration du SMR (ASMR V) ;
- un SMR insuffisant pour le reste de la population de l’AMM au regard des alternatives disponibles.
La CT précise que dans la stratégie thérapeutique du cholangiocarcinome intrahépatique au stade métastatique, le traitement de première ligne est une chimiothérapie par gemcitabine et cisplatine. En France, le protocole GEMOX (gemcitabine, oxaloplatine) est aussi utilisé dans cette situation. Chez les patients relevant d'une deuxième ligne de traitement systémique, le protocole FOLFOX (acide folinique/oxyplatine) est une option thérapeutique.
Une étude non comparative évaluant le taux de réponse objective
Pour réaliser l'évaluation médico-économique de PEMAZYRE, la CT a notamment pris en compte les données de l'étude multicentrique de phase II non comparative FIGHT-202 [2] ayant évalué l'effet du pemigatinib dans trois cohortes de patients prétraités pour un cholangiocarcinome localement avancé/métastatique ou chirurgicalement non résécable (n = 145) ; parmi les trois cohortes, la cohorte A (n = 107) a permis d'évaluer l'efficacité de PEMAZYRE dans l'indication de l'AMM (patients avec un réarrangement ou une fusion de FGFR2).
Le critère de jugement principal était le taux de réponse objective* chez des patients ayant une fusion ou un réarrangement de FGFR2 détecté par analyse centralisée.
À l'issue du suivi médian de 15,44 mois, ce taux a été de 35,5 % (IC95% : 26,50 - 45). Parmi les patients répondeurs, 3 patients ont eu une réponse complète (2,8 %) et 35 patients une réponse partielle (32,7 %).
La médiane de survie sans progression a été de 6,93 mois (IC95% : 6,18 - 9,59) dans le groupe pemigatinib. La médiane de survie globale n'a pas été atteinte (37,4 % des patients étaient décédés).
Dans son évaluation, la CT a tenu compte de l'absence de comparaison de PEMAZYRE aux alternatives disponibles, notamment le protocole de chimiothérapie par FOLFOX chez les patients en échec à une première ligne de traitement, alors qu'elle était possible lors de la réalisation de l'étude.
* proportion de patients qui ont atteint une réponse complète (disparition de toutes les lésions cibles) ou une réponse partielle (diminution d’au moins 30 % de la somme des diamètres les plus longs des lésions cibles) selon les critères RECIST v1.1.
Un surcroît de toxicité
La CT note également le surcroît de toxicité de PEMAZYRE, notamment :
- une incidence d'événements indésirables (EI) de grades ≥ 3 de 59,8 %, dont les plus fréquents (> 5 %) ont été : hypophosphatémie (12,1%), stomatite (7,5 %), arthralgie (6,5 %) et érythrodysesthésie palmo-plantaire (5,6 %) ;
- et celle des EI graves de 40,2 %, à type de fièvre (4,7 %), douleurs abdominales (3,7 %), cholangite (3,7 %) et cholangite infectieuse (2,8 %), pour les plus fréquents (> 2 %).
Deux risques importants sont par ailleurs cités dans le plan de gestion des risques (PGR) : le décollement séreux rétinien et l'hyperphosphatémie.
PEMAZYRE en pratique
Le traitement doit être initié par un médecin expérimenté dans le diagnostic et le traitement des patients atteints d'un cancer des voies biliaires.
Avant d'initier le traitement par PEMAZYRE, la présence d'une fusion du gène FGFR2 doit être confirmée par un test de diagnostic approprié sur un échantillon tumoral.
Un test de grossesse doit être réalisé afin d'exclure une grossesse.
Posologie : des cycles de 21 jours, dont 14 jours avec le pemigatinib
La dose recommandée est de 13,5 mg de pemigatinib 1 fois par jour pendant 14 jours, suivie de 7 jours d'arrêt du traitement.
Les comprimés doivent être pris environ à la même heure chaque jour, avec ou sans nourriture. Les patients ne doivent pas écraser, mâcher, couper ou dissoudre les comprimés.
Le traitement doit être poursuivi aussi longtemps que le patient ne présente pas de signes de progression de la maladie ou de toxicité inacceptable.
Surveiller le risque d'hyperphosphatémie
L'hyperphosphatémie est un effet pharmacodynamique attendu avec l'administration de pemigatinib. Les complications d'une hyperphosphatémie prolongée sont une hypocalcémie, une minéralisation des tissus mous, des crampes musculaires, une activité convulsive, un allongement de l'intervalle QT et des arythmies.
Les recommandations pour la prise en charge de l'hyperphosphatémie pendant la prise de PEMAZYRE comprennent :
- la restriction de l'apport alimentaire de phosphates : chez tous les patients, un régime pauvre en phosphates doit être instauré lorsque le taux de phosphates sériques est > 5,5 mg/dL ;
- l'administration d'un traitement réduisant les phosphates : l'ajout d'un traitement réduisant les phosphates doit être envisagé lorsque le taux est > 7 mg/dL ;
- la modification de la dose de pemigatinib si nécessaire.
À l'inverse, un risque d'hypophosphatémie existe pendant les interruptions du traitement par PEMAZYRE, ou si le taux de phosphates sériques se trouve en dessous des valeurs normales. Dans ces cas, le traitement réduisant les phosphates et le régime doivent être arrêtés.
Les situations nécessitant l'ajustement posologique, ou l'arrêt du traitement
L'utilisation concomitante d'un médicament ou la consommation de produits alimentaires (jus de pamplemousse ou pamplemousse) peut nécessiter un ajustement de la dose du pemigatinib. C'est le cas avec les inhibiteurs puissants du CYP3A4, y compris le jus de pamplemousse. L'association avec le pemigatinib doit être évitée. Si l'administration concomitante de pemigatinib et d'un inhibiteur puissant du CYP3A4 est nécessaire, une adaptation posologique est requise :
- réduire la dose de 13,5 mg de pemigatinib 1 fois par jour à 9 mg 1 fois par jour ;
- si la dose prescrite est de 9 mg 1 fois par jour, elle doit être réduite à 4,5 mg 1 fois par jour.
En outre, l'utilisation concomitante de pemigatinib et d'inhibiteurs de la pompe à protons doit être évitée. PEMAZYRE ne doit pas être utilisé avec le millepertuis.
Une réduction des doses ou une interruption du traitement sont également recommandées dans les situations suivantes :
- survenue d'une toxicité, notamment oculaire (décollement séreux de la rétine)
- hyperphosphatémie.
L'état des fonctions rénale et hépatique est à prendre en compte avant d'initier le traitement. Une réduction de dose est nécessaire en cas d'insuffisance rénale ou hépatique.
Le traitement doit être arrêté définitivement si le patient est incapable de tolérer 4,5 mg de pemigatinib une fois par jour.
Pemigatinib et reproduction
Le pemigatinib expose à une toxicité embryofœtale, imposant les recommandations suivantes :
- un test de grossesse doit être réalisé avant l'initiation du traitement afin d'exclure une grossesse ;
- les femmes en âge de procréer doivent utiliser un moyen de contraception efficace pendant le traitement par pemigatinib et pendant 1 semaine après la dernière dose ;
- les hommes ayant des partenaires féminines en âge de procréer doivent utiliser un moyen de contraception efficace pendant le traitement par pemigatinib et pendant au moins 1 semaine après la dernière dose.
À dire aux patients
En cas de sécheresse oculaire, un émollient ophtalmique peut être prescrit.
Les patients doivent éviter de consommer du pamplemousse ou du jus de pamplemousse pendant le traitement par pemigatinib.
Identité administrative
Liste I
Prescription hospitalière
Prescription réservée aux spécialistes en oncologie ou aux médecins compétents en cancérologie
Surveillance particulière pendant le traitement
PEMAZYRE 4,5 mg comprimé, boîte de 14, CIP 3400930223697
PEMAZYRE 9 mg comprimé, boîte de 14, CIP 3400930223703
PEMAZYRE 13,5 mg comprimé, boîte de 14, CIP 3400930223710
Remboursable à 100 % (cf. Encadré) [3]
Prix public TTC = 6 448,38 euros
Agrément aux collectivités (cf. Encadré) [4]
Laboratoire Incyte Biosciences
| PEMAZYRE est remboursable et agréé aux collectivités uniquement dans le sous-groupe de patients atteints d'un cholangiocarcinome intrahépatique localement avancé ou métastatique avec fusion ou réarrangement du gène du récepteur 2 du facteur de croissance des fibroblastes (FGFR2) qui ont progressé après au moins une ligne de traitement systémique et non éligibles à une chimiothérapie par FOLFOX. |
[1] Avis de la Commission de la transparence - PEMAZYRE (HAS, 21 juillet 2021)
[2] Abou-Alfa GK, Sahai V, Hollebecque A, Vaccaro G, Melisi D, Al-Rajabi R et al. Pemigatinib for previously treated, locally advanced or metastatic cholangiocarcinoma: a multicentre, open-label, phase 2 study. Lancet Oncol., 2020; 21(5): 671–84
[3] Arrêté du 19 octobre 2022 modifiant la liste des spécialités pharmaceutiques remboursables aux assurés sociaux - PEMAZYRE (Journal officiel du 25 octobre 2022, texte 12)
[4] Arrêté du 19 octobre 2022 modifiant la liste des spécialités pharmaceutiques agréées à l'usage des collectivités et divers services publics - PEMAZYRE (Journal officiel du 25 octobre 2022, texte 13)

 9 minutes
9 minutes Ajouter un commentaire
Ajouter un commentaire.png)




Commentaires
Cliquez ici pour revenir à l'accueil.