Les crises d’épilepsie impactent fortement la qualité de vie des patients et celle de leurs aidants.
EPIDYOLEX 100 mg/mL solution buvable peut désormais être délivré en pharmacie d'officine, sur prescription initiale hospitalière d'un neurologue ou d'un neuropédiatre.
EPIDYOLEX est la première spécialité à base de cannabidiol commercialisée en France. Avant cette commercialisation « officielle », EPIDYOLEX a été disponible en autorisation temporaire d'utilisation (dès 2018), puis en autorisation d'accès compassionnel (AAC) qui a pris fin le 21 décembre 2022.
EPIDYOLEX est indiqué en neurologie, dans le traitement adjuvant des crises d'épilepsie chez l'adulte et chez l'enfant de 2 ans et plus :
- en association au clobazam, dans le traitement adjuvant des crises d'épilepsie associées au syndrome de Lennox-Gastaut (SLG) ou au syndrome de Dravet (SD) ;
- dans le traitement adjuvant des crises d'épilepsie associées à une sclérose tubéreuse de Bourneville (STB).
La posologie d'EPIDYOLEX est :
- en initiation, de 2,5 mg/kg 2 fois par jour (5 mg/kg/jour) pendant une semaine ;
- puis de 5 mg/kg 2 fois par jour (10 mg/kg/jour), correspondant à la dose d'entretien dans le cadre d'un SLG ou SD.
L'augmentation de dose doit se faire par paliers de 2,5 mg/kg 2 fois par jour, jusqu'à une dose maximale de :
- 10 mg/kg 2 fois par jour (20 mg/kg/jour) dans l'indication SLG et SD ;
- 12,5 mg/kg 2 fois par jour (25 mg/kg/jour) dans l'indication STB.
L'arrêt du traitement doit se faire progressivement, par paliers.
La fonction hépatique (transaminases, bilirubine) doit être étroitement surveillée pendant le traitement, en raison d'un risque d'atteinte hépatocellulaire associé au cannabidiol.
D'un point de vue pratique, EPIDYOLEX se présente en solution buvable prête à l'emploi, administrée avec une seringue pour administration orale. L'adaptateur doit être utilisé pour prélever la solution buvable.
Deux formats de seringues sont fournis, à choisir en fonction de la posologie prescrite :
- dose de 100 mg ou moins ((1 mL ou moins) : utiliser la seringue de 1 mL ;
- dose supérieure à 100 mg (plus de 1 mL) : utiliser la plus grande seringue de 5 mL.
Pour éviter des erreurs médicamenteuses, il est recommandé d'exprimer la dose à administrer en mL sur l'ordonnance, étant donné que le dispositif d'administration est gradué en mL.
EPIDYOLEX peut être pris avec ou sans aliments, mais l'administration doit se faire dans les mêmes conditions chaque jour.
L'administration par sonde nasogastrique ou gastrostomie peut être envisagée si nécessaire.
EPIDYOLEX est agréé aux collectivités et remboursable à 65 % (boîte de 1 flacon = 1 066,74 euros). Dans le cadre des crises d'épilepsie associées à une sclérose tubéreuse de Bourneville, le périmètre de remboursement est restreint aux patients présentant une épilepsie pharmacorésistante.
La spécialité à base de cannabidiol EPIDYOLEX 100 mg/mL solution buvable est désormais disponible en pharmacie d'officine. Jusqu'à présent, elle était mise à disposition dans le cadre d'une autorisation temporaire d'utilisation ATU (dès juin 2018), puis d'une autorisation d'accès compassionnel AAC qui a pris fin le 21 décembre 2022.
EPIDYOLEX est un médicament de neurologie, indiqué chez l'adulte et l'enfant de 2 ans et plus (cf. VIDAL Recos « Épilepsie de l'adulte » et « Épilepsie de l'enfant ») :
- en association au clobazam, dans le traitement adjuvant des crises d'épilepsie associées au syndrome de Lennox-Gastaut (SLG) ou au syndrome de Dravet (SD) ;
- dans le traitement adjuvant des crises d'épilepsie associées à une sclérose tubéreuse de Bourneville (STB).
Évaluation médico-économique : d'un SMR important à insuffisant selon l'indication
EPIDYOLEX a fait l'objet de deux avis successifs par la Commission de la transparence (CT) :
- un premier avis en 2020 portant sur l'indication en traitement des crises d'épilepsie associées au syndrome de Lennox/Gastaut et au syndrome de Dravet [1] ;
- un second avis en 2021 portant sur l'indication en traitement des crises d’épilepsie associées à une sclérose tubéreuse de Bourneville [2].
Un SMR important et une ASMR mineure dans le cadre des syndromes de Lennox-Gastaut et de Dravet
Selon son avis du 13 mai 2020, la CT a attribué à EPIDYOLEX dans le traitement des crises d'épilepsie associées au syndrome de Lennox-Gastaut ou au syndrome de Dravet :
- un service médical rendu (SMR) important dans l'indication de l'autorisation de mise sur le marché (AMM) ;
- une amélioration du SMR mineure (ASMR IV).
La CT s'est notamment appuyée sur les données issues de quatre études cliniques de phase III, de schémas similaires, randomisées en double aveugle ayant évalué la supériorité du cannabidiol versus placebo, en adjuvant d'un traitement conventionnel (clobazam principalement) :
- deux études dans le traitement des crises associées au syndrome de Dravet chez l'enfant : GWPCARE1-B (correspondant à la partie B de l'étude - La partie A correspondait à une étude de recherche de dose) [3] et GWPCARE2 (non publiée au moment de l'évaluation par la CT) ;
- deux études dans le traitement des crises associées au syndrome de Lennox-Gastaut chez l'enfant et l'adulte : GWPCARE3 [4] et GWPCARE4 [5].
Dans ces études, la supériorité d'EPIDYOLEX a été démontrée sur les critères de jugement principal suivants :
- pour le syndrome de Dravet : variation de la fréquence totale des crises convulsives à court terme sur 14 semaines, la différence médiane observée ayant été de -22,8 % IC95% [-41,1 ; -5,4] (p = 0,0123) versus placebo (étude GWPCARE1-B) et le pourcentage de réduction de 25,7 % IC95% [2,9 ; 43,2] (p = 0,0299) à 29,8 % IC95% [8,4 ;46,2] (p = 0,0095) [étude GWPCARE2] ;
- pour le syndrome de Lennox-Gastaut : variation de la fréquence totale des crises avec chute à court terme sur 14 semaines par rapport à l'inclusion, la différence médiane observée versus placebo ayant été de -17,2 % IC95% [-30,3 ; -4,1] (p = 0,0135) [GWPCARE4] à -21,6 % IC95% [-34,8 ; -6,7] (p = 0,0047) [GWPCARE3].
La Commission a « salué la réalisation d'essais cliniques comparatifs de phase III dans ces maladies rares et pédiatriques ».
Sclérose de Bourneville : un SMR favorable uniquement en présence de pharmacorésistance
L'avis du 1er décembre 2021 a porté sur les crises d’épilepsie associées à une sclérose tubéreuse de Bourneville (STB). La CT a attribué un SMR favorable à EPIDYOLEX dans une indication restreinte par rapport à celle de l'AMM :
- SMR modéré uniquement chez les patients de 2 ans et plus avec épilepsie pharmacorésistante ;
- SMR insuffisant chez les patients avec épilepsie non pharmacorésistante ;
- aucune ASMR.
La CT s'est appuyée sur les données d’une étude pivot ayant combiné deux études cliniques de phase III :
- l'étude multicentrique internationale, GWPCARE6 [6] en double aveugle, randomisée, contrôlée versus placebo : ayant démontré la supériorité du cannabidiol en termes de réduction du nombre de crises associées à la STB pendant la période de traitement (16 semaines) par rapport à l'inclusion avec un pourcentage de réduction de 30,1 % IC95% [13,9 % ; 43,3 %] (p = 0,0009) chez des patients ayant un nombre médian de 54 à 61 crises par mois à l’inclusion, dans un contexte de pharmacorésistance élevée ;
- l'étude de suivi en ouvert GWPCARE6-OLE, extension de l'étude GWPCARE6 visant à évaluer la tolérance à long terme du cannabidiol et ayant montré, après une durée médiane de 38 semaines [3 - 130 semaines], des effets indésirables (EI) similaires à ceux déjà identifiés avec le cannabidiol, à savoir majoritairement : diarrhée (44,7 %), crises d’épilepsies (28,1 %), diminution de l’appétit (23,1 %), pyrexie (21,1 %) et vomissements (19,6 %).
À noter que des EI associés à une atteinte hépatique ont été rapportés dans le groupe cannabidiol, et non dans les groupes placebo. Il s'agissait d'élévations des concentrations biologiques cliniquement anormales en ALAT (12,0 %), en ASAT (10,7 %) et des GGT (16,0 %).
Recommandations posologiques
EPIDYOLEX est administré en 2 prises par jour.
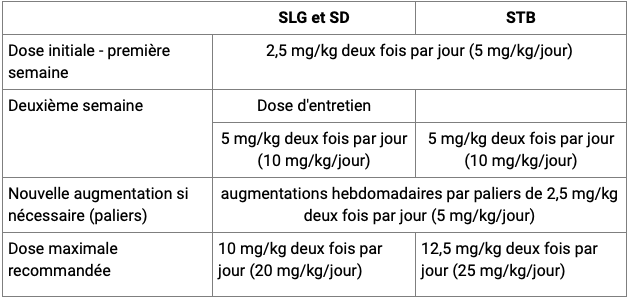
La posologie de cannabidiol recommandée est la suivante (cf. Tableau) :
- dose initiale : 2,5 mg/kg 2 fois par jour (5 mg/kg/jour) pendant une semaine ;
- au bout d'une semaine, la dose doit être augmentée à une dose de 5 mg/kg 2 fois par jour (10 mg/kg/jour), correspondant à une dose d'entretien dans le cadre d'un SLG ou SD.
Selon la réponse clinique et la tolérance individuelles, chaque dose pourra être augmentée chaque semaine par paliers de 2,5 mg/kg 2 fois par jour (5 mg/kg/jour) :
- jusqu'à une dose maximale recommandée de 10 mg/kg 2 fois par jour (20 mg/kg/jour) dans le cadre d'un SLG ou d'un SD ;
- jusqu'à une dose maximale recommandée de 12,5 mg/kg 2 fois par jour (25 mg/kg/jour) dans le cadre d'une STB.
Une adaptation posologique est nécessaire chez les patients atteints d'une insuffisance hépatique modérée à sévère ou recevant d'autres médicaments (notamment antiépileptiques).
Lors de l'arrêt du traitement, la dose doit être diminuée progressivement.
Tableau résumant les recommandations posologiques en fonction des indications (extrait de la monographie VIDAL)
Surveillance des patients sous EPIDYOLEX : hépatique et psychiatrique
La surveillance des patients sous EPIDYOLEX porte principalement sur la fonction hépatique, en raison d'un risque d'atteinte hépatocellulaire associé au cannabidiol.
En effet, le cannabidiol expose à des élévations dose-dépendantes des transaminases hépatiques (alanine aminotransférase [ALAT] et/ou aspartate aminotransférase [ASAT]) survenant généralement dans les 2 mois suivant l'instauration du traitement.
Cependant, des cas ont été observés jusqu'à 18 mois après l'instauration du traitement, en particulier chez les patients prenant un traitement associé par valproate.
Avant l'instauration du traitement par cannabidiol, les taux sériques de transaminases (ALAT et ASAT) et de bilirubine totale doivent être contrôlés.
Pendant le traitement, les taux sériques de transaminases et de bilirubine totale doivent être contrôlés 1 mois, 3 mois et 6 mois après l'instauration du traitement par cannabidiol, et périodiquement par la suite ou selon l'indication clinique.
En cas de modification de la dose de cannabidiol supérieure à 10 mg/kg/jour ou tout changement au niveau des médicaments associés (modification de la dose ou ajout d'un autre traitement) susceptibles d'avoir un impact sur le foie, ce programme de surveillance doit être réinitié.
Les patients présentant des élévations initiales de l'ALAT ou de l'ASAT et les patients qui prennent du valproate doivent faire l'objet d'une surveillance intensifiée, comportant un dosage des taux sériques de transaminases et de bilirubine totale à 2 semaines, 1 mois, 2 mois, 3 mois et 6 mois après l'instauration du traitement par cannabidiol, et régulièrement par la suite ou selon l'indication clinique.
La surveillance au cours du traitement par cannabidiol porte également sur :
- le repérage d'éventuels signes de comportements et d'idées suicidaires ;
- une perte de poids ou une baisse de l'appétit, ou l'absence de prise de poids chez les enfants.
EPIDYOLEX en pratique
EPIDYOLEX est conditionné en boîte de 1 flacon de 100 mL de solution buvable prête à l'emploi, accompagné de :
- 2 seringues de 1 mL avec des graduations de 0,05 mL et un adaptateur. Chaque palier de 0,05 mL correspond à 5 mg de cannabidiol ;
- 2 seringues de 5 mL avec des graduations de 0,1 mL et un adaptateur. Chaque palier de 0,1 mL correspond à 10 mg de cannabidiol.
Pour chacun de ces conditionnements, la deuxième seringue correspond à une seringue de rechange dans le cas où la première serait endommagée ou égarée.
Une fois le flacon ouvert pour la première fois, la solution buvable doit être utilisée dans les 12 semaines.
Sélection de la seringue
La seringue qui sera utilisée pour l'administration doit être adaptée à la dose prescrite :
- si la dose calculée est de 100 mg ou moins (soit 1 mL de solution ou moins), la plus petite seringue de 1 mL doit être utilisée ;
- si la dose calculée est supérieure à 100 mg (soit plus de 1 mL de solution), la plus grande seringue de 5 mL devra être utilisée.
L'adaptateur fourni permet de connecter la seringue au flacon, pour prélever la solution buvable.
Prescrire la dose en mL
La dose calculée doit être arrondie au palier le plus proche.
Pour éviter des erreurs médicamenteuses, la dose prescrite doit être exprimée en mL sur l'ordonnance pour être en cohérence avec la graduation (en mL) du dispositif d'administration.
En septembre 2021, la Haute Autorité de santé (HAS) a publié une fiche relative au risque d'erreur de dose lié au dispositif d'administration d'EPIDYOLEX (fiche élaborée dans le cadre du système d'aide à la décision indexée par médicament référencé par la HAS) [7] dans laquelle elle recommande aux professionnels de santé :
- lors de la prescription : indiquer sur l'ordonnance la dose à administrer en mL ;
- lors de la dispensation : si la prescription est exprimée en mg, faire la conversion en mL, et indiquer au patient la seringue à utiliser.
Des conditions d'administration identiques chaque jour
EPIDYOLEX peut être pris avec ou sans aliments, y compris en cas de régime cétogène (repas riche en matières grasses), en respectant des conditions de prise identiques chaque jour.
En cas de prise avec des aliments, une composition alimentaire similaire doit être envisagée, si possible. L'alimentation peut augmenter les niveaux de cannabidiol.
L'administration par voie orale est recommandée ; les sondes nasogastriques et de gastrostomie peuvent être utilisées, si nécessaire, pour une administration entérale.
Identité administrative
Liste I [8]
Prescription initiale hospitalière annuelle
Prescription initiale et renouvellement réservés aux spécialistes en neurologie et neuropédiatrie
Surveillance particulière pendant le traitement
Flacon de 100 mL + 4 seringues + 2 adaptateurs, CIP 3400930187968
Remboursable à 65 % [9] (cf. Encadré)
Prix public TTC = 1 066,74 euros [10]
Agrément aux collectivités [11] (cf. Encadré)
Laboratoire Jazz Pharmaceuticals
|
[1] Avis de la Commission de la transparence - EPIDYOLEX/syndrome de Lennox-Gastaut ou syndrome de Dravet (HAS, 13 mai 2020)
[2] Avis de la Commission de la transparence - EPIDYOLEX/sclérose de Bourneville (HAS, 1er décembre 2021)
[3] Devinsky O, Cross JH, Laux L et al. Trial of Cannabidiol for Drug-Resistant Seizures in the Dravet Syndrome. N Engl J Med., 2017; 376: 2011-2020
[4] Devinsky O, Patel AD, Cross JH et al. Effect of cannabidiol on drop seizures in the Lennox-Gastaut syndrome. N Engl J Med., 2018; 378: 1888-1897
[5] Thiele EA, Marsh ED, French JA et al. Cannabidiol in patients with seizures associated with Lennox-Gastaut syndrome (GWPCARE4): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet, 2018; 391: 1085-1096
[6] Thiele EA, Bebin EM, Bhathal H et al. Add-on Cannabidiol Treatment for Drug-Resistant Seizures in Tuberous Sclerosis Complex: A Placebo-Controlled Randomized Clinical Trial. JAMA Neurol., 2021; 78(3): 285-292. doi: 10.1001/jamaneurol.2020.4607
[7] Alerter sur le risque d'erreur de dose lié au dispositif d'administration de EPIDYOLEX 100 mg/mL solution buvable (HAS, 9 septembre 2021)
[8] Arrêté du 21 janvier 2020 portant exonération à la réglementation des stupéfiants et portant classement sur la liste I des substances vénéneuses - EPIDYOLEX (Journal officiel du 24 janvier 2020 - texte 11)
[9] Arrêté du 14 décembre 2022 modifiant la liste des spécialités pharmaceutiques remboursables aux assurés sociaux - EPIDYOLEX (Journal officiel du 16 décembre 202 - texte 36)
[10] Avis relatif aux prix d'une spécialité pharmaceutique - EPIDYOLEX (Journal officiel du 16 décembre 2022 - texte 103)
[11] Arrêté du 14 décembre 2022 modifiant la liste des spécialités pharmaceutiques agréées à l'usage des collectivités et divers services publics - EPIDYOLEX (Journal officiel du 16 décembre 2022 - texte 37)

 10 minutes
10 minutes Ajouter un commentaire
Ajouter un commentaire






Commentaires
Cliquez ici pour revenir à l'accueil.