Les corps de Lewy sont constitués en grande partie d’amas intracytoplasmiques d’alpha-synucléine. Nemes Laszlo / iStock/Getty Images Plus / via Getty Images
Entre 150 000 et 200 000 personnes ont une maladie de Parkinson (MP) en France et, en raison du vieillissement de la population mondiale, le nombre de patients ayant cette affection risque de doubler dans les pays développés.
Les progrès effectués en neurosciences au cours des deux derniers siècles ont permis de comprendre que la dopamine était au cœur des symptômes moteurs de la MP (tremblement de repos, akinésie, rigidité).
La cause de la MP reste encore inconnue en 2024. Mais plusieurs facteurs environnementaux et génétiques sont suspectés. En particulier, il a été montré que les pesticides augmentaient le risque de MP. Et, sur le plan génétique, une centaine de gènes sont désormais incriminés. Certains ont une forte pénétrance et d’autres modulent la probabilité de développer la maladie.
L'alpha-synucléine représente un marqueur histologique et une cible majeure des essais thérapeutiques. Le marquage avec cette protéine suggère une origine extra-cérébrale de la maladie et a remis en cause le dogme de signes uniquement moteurs. Les symptômes non moteurs, comme les troubles de l’odorat ou du sommeil, sont mieux connus et pris en compte.
À la suite de ce premier article traitant de la physiopathologie de la MP, deux autres suivent, respectivement, sur le diagnostic et l'imagerie, puis sur la prise en charge thérapeutique.
La maladie de Parkinson (MP) est la seconde pathologie neurodégénérative la plus fréquente derrière la maladie d'Alzheimer. Entre 150 000 et 200 000 personnes ont une MP en France. Les hommes sont plus souvent touchés que les femmes (sex-ratio de 1,5) et l'âge est un des principaux facteurs de risque (la maladie survenant préférentiellement après 60 ans). Ainsi, la prévalence est de 107 sur 100 000 chez les sujets de 50 à 59 ans et de 1 087 sur 100 000 entre 70 et 79 ans. En raison du vieillissement de la population mondiale, le nombre de patients ayant cette affection risque de doubler dans les pays développés.
Les données sur la mortalité sont hétérogènes, mais une étude rapporte une durée médiane de survie de 12,6 ans versus 16 ans chez les sujets contrôles.
Zoom arrière sur deux siècles d’histoire
Les deux cents ans de l'histoire de la MP illustrent les nombreux progrès effectués en neurosciences.
- Tout a débuté au XIXe siècle avec James Parkinson, praticien britannique et politicien déçu, qui est entré dans l'histoire de la médecine en 1817 en décrivant une nouvelle maladie : « the Shaking Palsy » dans un ouvrage désormais célèbre. La fameuse triade (tremblement de repos, akinésie, rigidité) est depuis restée la base sémiologique de cette affection.
- À la fin du XIXe siècle, la méthode anatomoclinique, chère aux neurologues français, a permis d’identifier une zone cérébrale cruciale responsable des symptômes parkinsoniens : la substance noire.
- Une corrélation entre les inclusions neuronales détectées par Frederic Lewy* dans la substance noire et la survenue d’une MP a été établie en 1919 par le neuropathologiste russe, Konstantin Tretiakoff.
- Pendant un demi-siècle, la MP est restée sans traitement jusqu'à la découverte des effets pharmacologiques de la dopamine par Arvid Carlsson (médecin et neurobiologiste suédois), récompensé vingt ans plus tard, en l’an 2000, par un prix Nobel. En 2024, ce modèle dopaminergique domine encore la recherche thérapeutique.
- Au cours de ces vingt dernières années, de nombreuses substances permettant une stimulation dopaminergique continue ont été développées afin de limiter l’apparition des dyskinésies et des fluctuations motrices.
- Parallèlement, des approches novatrices ont permis de proposer des thérapies de seconde ligne. En particulier, la France s’est illustrée avec la neurostimulation (Alim Louis Benabid) et les pompes à apomorphine sous-cutanées (Pierre Pollak).
Depuis, la recherche thérapeutique n’a pas (encore) réussi à mettre au point des thérapies efficaces sur la neurodégénérescence et les manifestations non dopaminergiques responsables des nombreux symptômes non moteurs. Pourtant, les chercheurs ont exploré des techniques originales comme les greffes de cellules fœtales, puis de cellules souches, ou encore, la thérapie génique neuroprotectrice et les thérapies ciblées par anticorps monoclonaux.
La physiopathologie complexe de la maladie, qui implique des mécanismes multiples (dysfonction mitochondriale, stress oxydant, recyclage de protéines…), explique ces premiers échecs.
*médecin allemand, puis américain.
La piste des produits toxiques
Afin d'agir sur le processus dégénératif, d’importants efforts de recherche ont été effectués pour comprendre la physiopathologie de cette maladie et des données épidémiologiques ont ainsi suggéré l'implication de facteurs environnementaux dont certains ont pu être confirmés.
La piste des pesticides (fongicides, insecticides, herbicides) a été très largement explorée. Mais, cette recherche n'a pas permis d'incriminer une substance chimique précise. Certains produits phytopharmaceutiques, comme le paraquat (herbicide), ont toutefois été interdits.
Un travail, qui s'est appuyé sur des séries cliniques, a été fondamental, car il a permis de montrer une relation directe entre l'exposition à un produit chimique, le MPTP (méthyl phényl tétrahydro pyridine), et l'apparition de la maladie. Il s'agit de la publication dans les années 1980 de cas de MP survenus en Californie chez des sujets jeunes consommateurs de drogues hallucinogènes. Le produit incriminé, le MPTP, s'est avéré être particulièrement toxique pour la substance noire entraînant des lésions similaires à celles observées dans la MP, dite « idiopathique ».
Cependant, ce produit, utilisée depuis dans de nombreux modèles animaux, ne paraît pas provoquer la maladie chez tous les consommateurs. De même, l’exposition aux pesticides dans la population générale ne déclenche pas de MP chez toutes les personnes exposées. D'autres agents, en cours d'identification, sont ainsi en cause. En particulier, les études épidémiologiques ont pointé du doigt l’exposition au manganèse, ou à certains solvants.
À noter que, depuis mai 2012, la MP est reconnue comme maladie professionnelle sous certaines conditions dans le régime agricole en cas d’exposition aux pesticides** (cf. Tableau 58). De nouveaux documents/fiches toxicologiques sont régulièrement publiés sur le site de l’Institut national de recherche et de sécurité (INRS).
Certaines études ont également rapporté le rôle protecteur de la vagotomie et de l’appendicectomie, ainsi que l’impact néfaste de la pollution de l’air. Mais, cette liste évolue au fur et à mesure des publications et ces données épidémiologiques font souvent l’objet de résultats contradictoires.
**Le terme « pesticides » se rapporte aux produits à usages agricoles et aux produits destinés à l'entretien des espaces verts (produits phytosanitaires ou produits phytopharmaceutiques) ainsi qu'aux biocides et aux antiparasitaires vétérinaires, qu'ils soient autorisés ou non au moment de la demande.
Une centaine de gènes en ligne de mire
La MP est le plus souvent sporadique, mais il existe aussi de rares cas familiaux débutant avant 40 ans. Différents gènes, qui ont considérablement éclairé (et complexifié) la physiopathologie de la maladie, ont été impliqués. Nombre d’entre eux sont responsables de MP familiale monogéniques de transmission dominante ou récessive, mais ces derniers interviennent aussi dans les formes sporadiques beaucoup plus fréquentes de la maladie.
Parmi les 100 gènes actuellement incriminés :
- certains ont une forte pénétrance (leur présence provoque la maladie) et sont responsables de MP familiale (SNCNA, VPS35, PINK1, PRKN…) chez des adultes plus jeunes ;
- d’autres variants plus fréquents (GBA, LRRK2...) modulent le risque de MP familiale, et aussi sporadique.
Un marqueur histologique et une cible majeure
Le gène le plus célèbre est celui de l'alpha-synucléine. Cette protéine présente chez l’homme peut s'agréger de façon pathologique dans certains neurones pour former des inclusions cytoplasmiques, appelées corps de Lewy. Elle joue plusieurs rôles dans la biologie des vésicules synaptiques. Et il s’agit d’un marqueur histologique et d’une cible majeure des nouveaux essais thérapeutiques dans la MP.
D’autres anomalies génétiques ont orienté vers :
- un dysfonctionnement mitochondrial impactant le métabolisme énergétique cellulaire ;
- et/ou vers une atteinte du système lysosomial intervenant dans le recyclage de nombreuses protéines, dont l’alpha-synucléine.
Ces données ont complètement réorienté les axes de recherche de nouveaux médicaments et il est vraisemblable que l’on verra émerger dans les années à venir des traitements adaptés au profil génétique des patients.
En dehors des circuits moteurs cérébraux
La découverte de l'alpha-synucléine a été décisive, car il est devenu possible de marquer les cellules affectées par le processus neurobiologique de la MP et ainsi d’en préciser l’histoire naturelle. Les découvertes se sont enchaînées et ont battu en brèche le dogme d’une maladie à expression uniquement motrice. En effet, des troubles de l'odorat et du sommeil étaient décrits par les patients avant l’apparition des signes moteurs. Ceux-ci ont pu être expliqués par la découverte de lésions spécifiques, en dehors des circuits moteurs cérébraux, comme dans :
- le locus coeruleus ;
- le bulbe olfactif.
En utilisant le marquage avec l'alpha-synucléine, des anomalies similaires ont pu être observées dans les glandes salivaires, le système nerveux entérale et périphérique suggérant une origine extra-cérébrale de la maladie.
Le microbiote intestinal semble aussi impliqué, mais la compréhension de son rôle exact nécessite d’autres recherches.
Syndromes parkinsoniens : pour faire la différence
L'alpha-synucléine permet de différencier les syndromes parkinsoniens.
Dans la MP, le marquage est neuronal et il est présent au niveau du corps cellulaire et des neurites.
Dans l’atrophie multisystématisée, ce sont les oligodendrocytes qui sont marqués.
Ce marqueur n’est pas surexprimé dans les syndromes parkinsoniens type paralysie supranucléaire progressive ou dégénérescence cortico-basale.
Enfin, dans la maladie à corps de Lewy, le marquage est diffus dans tout le cerveau, et notamment dans le cortex.
La dopamine au cœur de la symptomatologie motrice
Tous ces progrès physiopathologiques n’ont pas diminué la place de la dopamine dans la MP. Pour rappel, ce neuromédiateur n'est présent que dans quelques structures cérébrales et notamment au niveau des noyaux gris centraux. Et, pour que des symptômes moteurs de la MP soient détectables, on considère qu’au moins 50 % des neurones de la substance noire doivent être affectés entraînant ainsi une déplétion dopaminergique dans le striatum. Le DAT scan, qui utilise un marqueur radioactif d'un transporteur de la dopamine, permet d’observer cette déplétion au niveau des terminaisons dopaminergiques striatales.
L’organisation cérébrale est complexe et met en jeu de multiples réseaux entre le cortex et le sous-cortex avec des boucles de rétrocontrôle. Il existe notamment deux boucles (l’une directe et l’autre indirecte) intervenant dans la régulation de l’initiation et du contrôle de l’intensité du mouvement.
Celles-ci impliquent plusieurs structures (cf. Figure) :
- le noyau thalamique ;
- le noyau sous-thalamique (subthalamique) ;
- la substance noire qui se divise en une partie compacte (Pars compacta) et une partie réticulée (Pars reticulata) ;
- le globus pallidus interne et externe ;
- le striatum (qui se compose du noyau caudé et du putamen).
Le traitement dopaminergique est efficace au début de la maladie sur la majorité des symptômes moteurs. Cependant, au cours de l'évolution, ses effets sont plus aléatoires, ce qui perturbe grandement la vie des patients.
Les symptômes non moteurs, parfois très invalidants (troubles attentionnels, mictionnels, hypotension…), ne répondent pas à la stimulation dopaminergique.
Figure - Organisation fonctionnelle du circuit moteur des noyaux gris centraux intervenant dans la planification motrice [1]
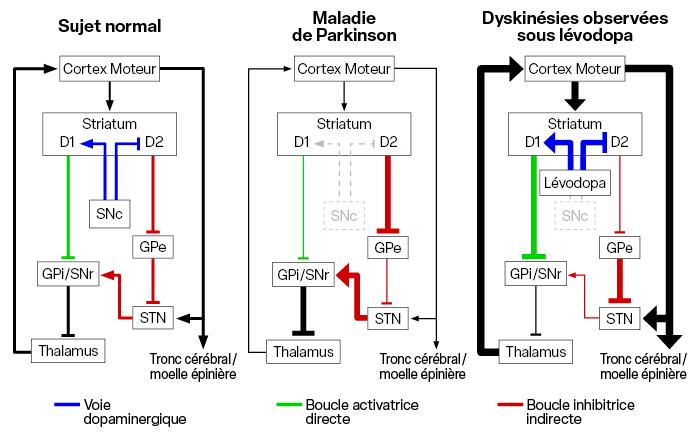
Maladie de Parkinson : la perte de dopamine entraîne une inhibition excessive des neurones thalamiques via la voie de contrôle directe (trait vert) et la voie de contrôle indirecte (trait rouge) expliquant ainsi la bradykinésie.
Dyskinésies observées sous lévodopa : ces dyskinésies sont en rapport avec une hyperstimulation de la voie activatrice directe.
GPe : globus pallidus externe. GPi : globus pallidus interne. SNc : substantia nigra pars compacta. SNr : substantia nigra pars reticulata. STN : noyau subthalamique.
Deux cibles et des résultats stimulants
Les connaissances fondamentales sur les circuits cérébraux impliqués dans la MP ont permis dans les années 1980 d’espérer moduler leur fonctionnement par la stimulation électrique. Cette hypothèse audacieuse a été couronnée de succès et a ouvert une nouvelle ère thérapeutique : la neuromodulation intracérébrale. Une électrode est implantée puis reliée à un neurostimulateur réglable qui permet de moduler le fonctionnement de la structure relais choisie.
Historiquement, la première cible était le noyau thalamique vim dont la stimulation a permis d’améliorer de façon importante le tremblement. Depuis, deux autres cibles, le noyau sous-thalamique et le globus pallidus interne, ont fait l'objet de très nombreuses études et ont participé à la diffusion de cette technique qui nécessite toutefois une précision millimétrique.
Les équipes françaises utilisent plus souvent la cible du noyau sous-thalamique que celle du globus pallidus interne. Ce geste peut désormais être réalisé :
- sous anesthésie générale ;
- avec des électrodes directionnelles ;
- en utilisant des piles rechargeables, ce qui évite les interventions chirurgicales pour les changer tous les cinq ans.
Les recherches se diversifient et se poursuivent
Les progrès dans le domaine de la MP s’accélèrent avec l’intelligence artificielle (qui autorise des diagnostics plus précoces), l’identification de biomarqueurs sanguins, l’imagerie cérébrale, la meilleure connaissance des symptômes non moteurs et les perspectives de la médecine prédictive. Cependant, l’absence persistante de médicaments neuroprotecteurs explique que les interventions non médicamenteuses et la prise en charge au quotidien des patients conservent une importance de tout premier plan.

 10 minutes
10 minutes Ajouter un commentaire
Ajouter un commentaire






Commentaires
Cliquez ici pour revenir à l'accueil.